В каких органоидах клетки содержатся рибосомы
Модель рибосомы Escherichia coli. Красным цветом выделена большая субьединица, синим — малая субьединица. Более светлым оттенком показаны рибосомные белки, более темным — рРНК
Рибосо́ма — важнейшая немембранная органелла всех живых клеток, служащая для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц. Малая субъединица считывает информацию с матричной РНК, а большая — присоединяет соответствующую аминокислоту к синтезируемой цепочке белка.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкреплённой форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
Схема синтеза рибосом в клетках эукариот.
1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Состав рибосомы[править | править код]
Рибосома представляют собой нуклеопротеид и состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Соотношение РНК/белок в рибосомах составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5,8S и 28S рРНК синтезируются в ядрышке РНК-полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируются РНК-полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) у цитоплазматических рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), у рибосом бактериальных клеток (а также у рибосом митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Рибосомные РНК[править | править код]
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы[править | править код]
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы[править | править код]
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки[править | править код]
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты[править | править код]
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции[править | править код]
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы[править | править код]
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Примечания[править | править код]
- ↑ 1 2 Спирин, 2011, с. 109.
- ↑ Спирин, 2011, с. 120—121.
- ↑ 1 2 Спирин, 2011, с. 110.
- ↑ 1 2 3 Спирин, 2011, с. 110—111.
- ↑ Спирин, 2011, с. 133—134.
- ↑ Спирин, 2011, с. 136—137.
- ↑ Спирин, 2011, с. 84—85.
- ↑ 1 2 Спирин, 2011, с. 84.
- ↑ Sievers A., Beringer M., Rodnina M. V., Wolfenden R. The ribosome as an entropy trap. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2004. — 25 May (vol. 101, no. 21). — P. 7897—7901. — doi:10.1073/pnas.0402488101. — PMID 15141076. [исправить]
- ↑ Schmeing T. M., Huang K. S., Strobel S. A., Steitz T. A. An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. (англ.) // Nature. — 2005. — 24 November (vol. 438, no. 7067). — P. 520—524. — doi:10.1038/nature04152. — PMID 16306996. [исправить]
- ↑ Hesslein A. E., Katunin V. I., Beringer M., Kosek A. B., Rodnina M. V., Strobel S. A. Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes. (англ.) // Nucleic Acids Research. — 2004. — Vol. 32, no. 12. — P. 3760—3770. — doi:10.1093/nar/gkh672. — PMID 15256541. [исправить]
- ↑ Nissen P., Hansen J., Ban N., Moore P. B., Steitz T. A. The structural basis of ribosome activity in peptide bond synthesis. (англ.) // Science (New York, N.Y.). — 2000. — 11 August (vol. 289, no. 5481). — P. 920—930. — PMID 10937990. [исправить]
- ↑ Schmeing T. M., Huang K. S., Kitchen D. E., Strobel S. A., Steitz T. A. Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction. (англ.) // Molecular Cell. — 2005. — 11 November (vol. 20, no. 3). — P. 437—448. — doi:10.1016/j.molcel.2005.09.006. — PMID 16285925. [исправить]
- ↑ PALADE GE. A small particulate component of the cytoplasm. (англ.) // The Journal Of Biophysical And Biochemical Cytology. — 1955. — January (vol. 1, no. 1). — P. 59—68. — doi:10.1083/jcb.1.1.59. — PMID 14381428. [исправить]
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. Crystal structure of the eukaryotic ribosome. (англ.) // Science (New York, N.Y.). — 2010. — 26 November (vol. 330, no. 6008). — P. 1203—1209. — doi:10.1126/science.1194294. — PMID 21109664. [исправить]
- ↑ Bokov K., Steinberg S. V. A hierarchical model for evolution of 23S ribosomal RNA. (англ.) // Nature. — 2009. — 19 February (vol. 457, no. 7232). — P. 977—980. — doi:10.1038/nature07749. — PMID 19225518. [исправить]
Литература[править | править код]
- Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Ссылки[править | править код]
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009 [1]
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [2] (англ.)
Источник
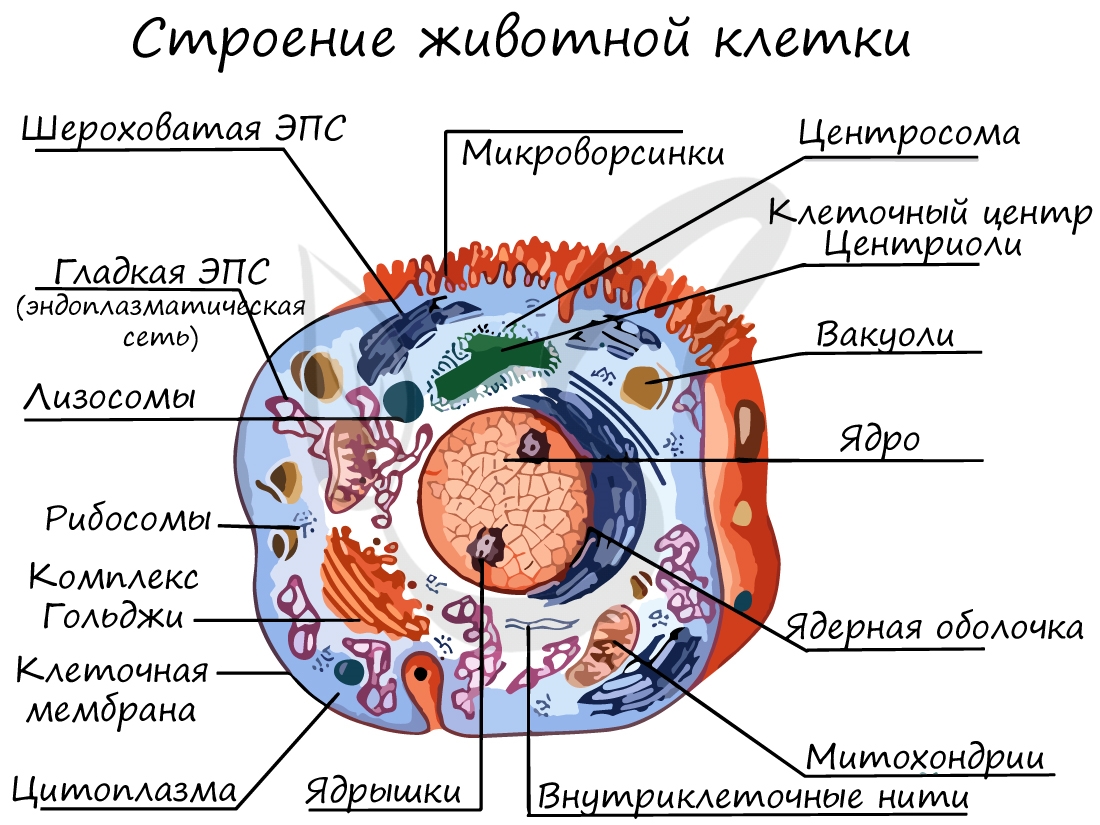
Органоиды (органеллы) клетки – специализированные структуры клетки, выполняющие различные жизненно необходимые
функции. Особенно сложно устроены клетки простейших, где одна клетка составляет весь организм и выполняет функции
дыхания, выделения, пищеварения и многие другие.
Органоиды клетки подразделяются на:
- Немембранные – рибосомы, клеточный центр, микротрубочки, органоиды движения (жгутики, реснички)
- Одномембранные – ЭПС, комплекс (аппарат) Гольджи, лизосомы и вакуоли
- Двумембранные – ядро, пластиды, митохондрии
Прежде чем говорить об органоидах клетки, без которых невозможна ее жизнедеятельность, необходимо
упомянуть о том, без чего вообще не существует клетки – о клеточной мембране. Клеточная мембрана ограничивает клетку
от окружающего мира и формирует ее внутреннюю среду.
Клеточная мембрана (оболочка)
Запомните, что в отличие от клеточной стенки, которая есть только у растительных клеток и у клеток грибов (она придает им плотную,
жесткую форму) клеточная мембрана есть у всех клеток без исключения! Этот важный момент объясню еще раз 🙂 У клеток животных имеется
только клеточная мембрана, а у клеток растений и грибов есть и клеточная стенка, и клеточная мембрана.
Клеточная мембрана представляет собой билипидный слой (лат. bi – двойной + греч. lipos – жир), который пронизывают молекулы
белков.
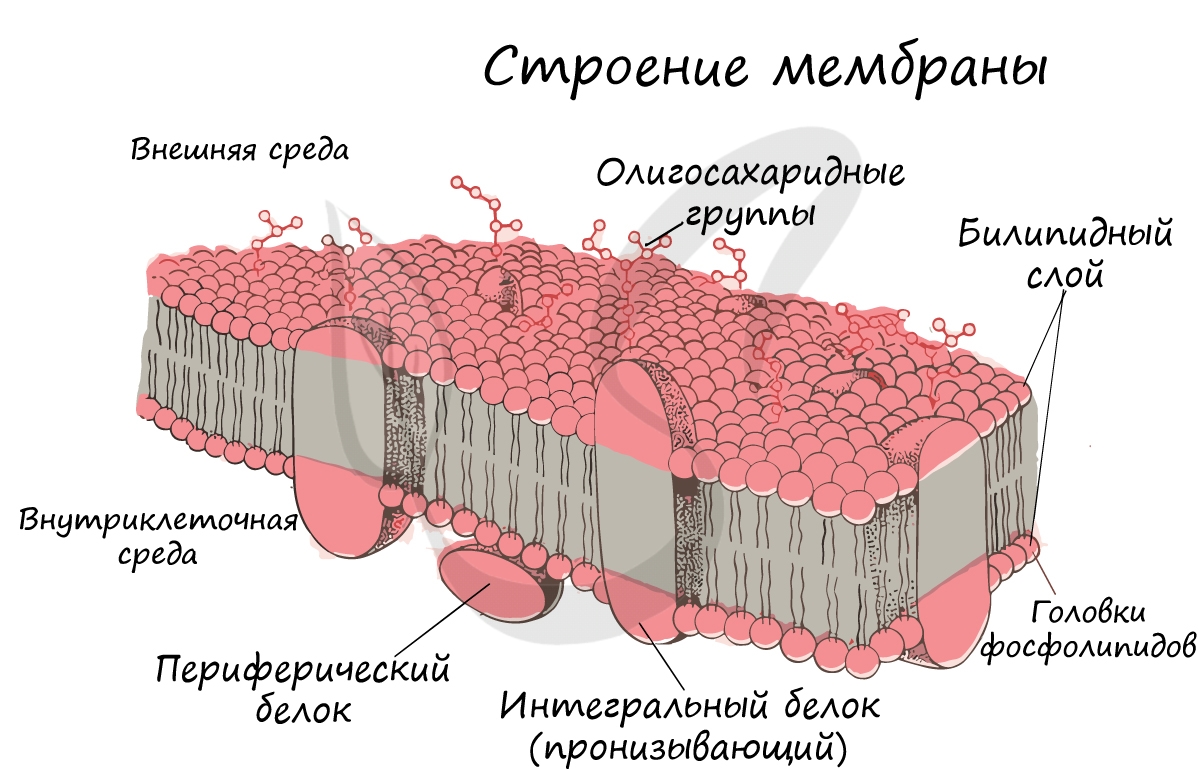
Билипидный слой представлен двумя слоями фосфолипидов. Обратите внимание, что их гидрофобные концы обращены внутрь мембраны, а
гидрофильные “головки” смотрят наружу. Билипидный слой насквозь пронизывают интегральные белки, частично – погруженные белки,
имеются также поверхностно лежащие белки – периферические.
Белки принимают участие в:
- Поддержании постоянства структуры мембраны
- Рецепции сигналов из окружающей среды (химического раздражения)
- Транспорте веществ через мембрану
- Ускорении (катализе) реакций, которые ассоциированы с мембраной
Интегральные (пронизывающие) белки образуют каналы, по которым молекулы различных веществ могут поступать в клетку или удаляться из нее.
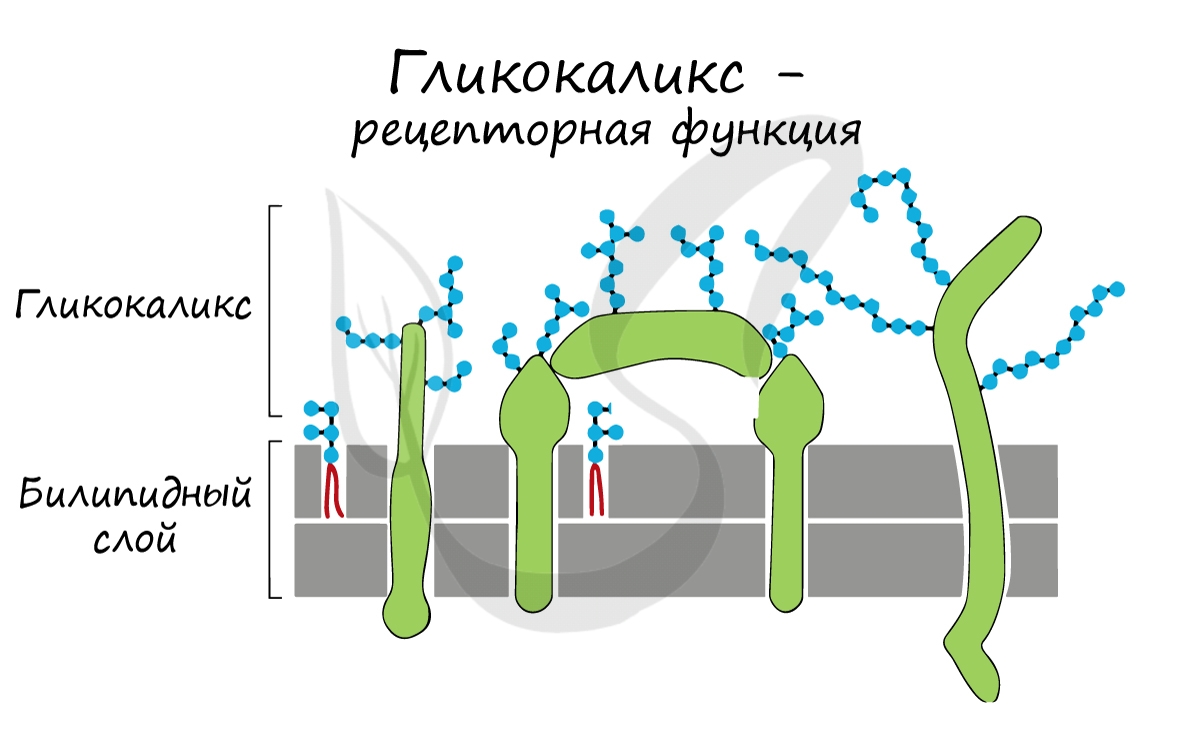
“Заякоренные” молекулы олигосахаридов на поверхности клетки образуют гликокаликс, который выполняет рецепторную функцию, участвует
в избирательном транспорте веществ через мембрану.

Теперь вы знаете, что гликокаликс – надмембранный комплекс, совокупность клеточных рецепторов, которые нужны клетке для восприятия регуляторных
сигналов биологически активных веществ (гормонов, гормоноподобных веществ). Гормон избирателен, специфичен и присоединяется
только к своему рецептору: меняется конформация молекулы рецептора и обмен веществ в клетке. Так гормоны
регулируют жизнедеятельность клеток.
Вирусы и бактерии не являются исключением: они взаимодействуют только с теми клетками, на которых есть подходящие к
ним рецепторы. Так вирус гриппа поражает преимущественно клетки слизистой верхних дыхательных путей. Однако если рецепторов
нет, то вирус не может проникнуть в клетку, и организм приобретает невосприимчивость к инфекции. Вспомните врожденный
иммунитет: именно по причине отсутствия рецепторов человек не восприимчив ко многим болезням животных.
Итак, вернемся к клеточной мембране. Ее можно сравнить со стенами помещения, в котором, вероятно, вы находитесь. Стены дома защищают
его от ветра, дождя, снега и прочих факторов внешней среды. Рискну предположить, что в вашем доме есть окна и двери, которые
по мере необходимости открываются и закрываются 🙂 Так и клеточная мембрана может сообщать внутреннюю среду клетки с внешней средой:
через мембрану вещества поступают в клетку и удаляются из нее.
Подведем итоги. Клеточная мембрана выполняет ряд важнейших функций:
- Разделительная (барьерная) – образует барьер между внешней средой и внутренней средой клетки (цитоплазмой с органоидами)
- Поддержание обмена веществ между внешней средой и цитоплазмой
- Транспортная
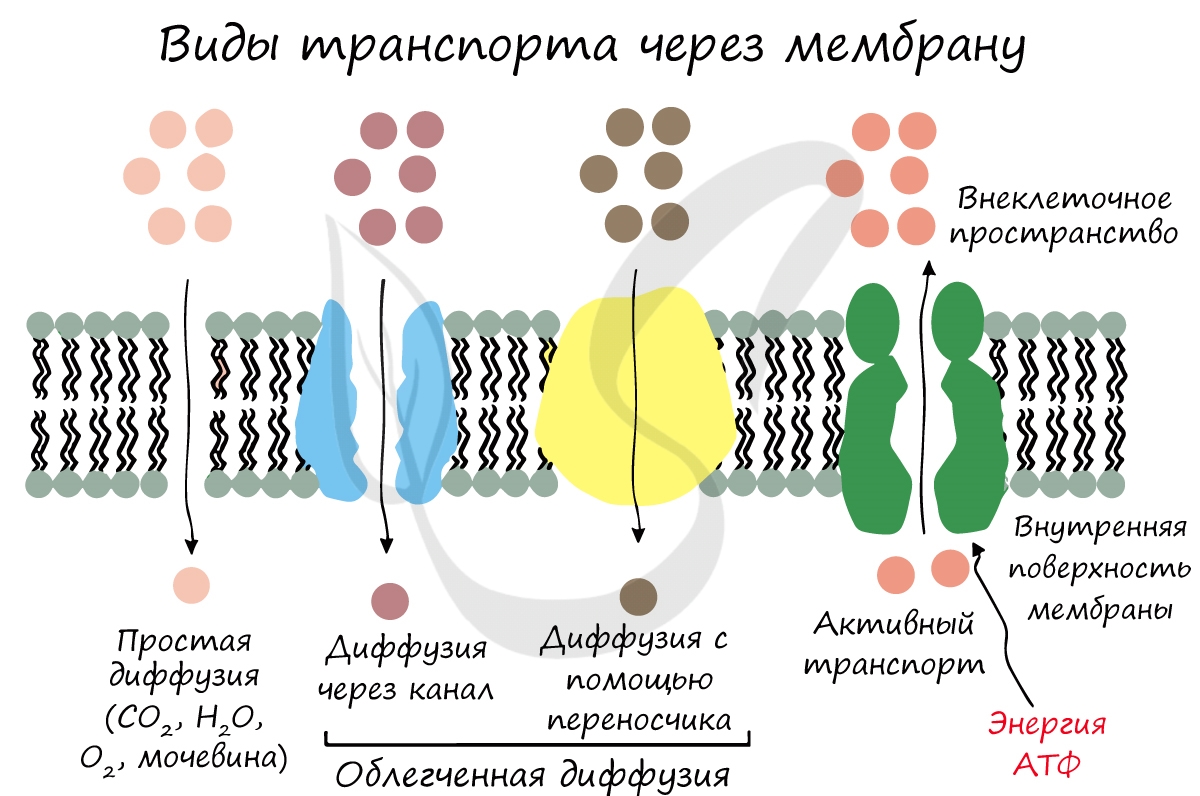
- Пассивный – часто идет по градиенту концентрации, без затрат АТФ (энергии). Возможен путем осмоса, простой диффузии
или облегченной (с участием белка-переносчика) диффузии. - Активный
Через мембрану по каналам кислород и питательные вещества поступают в клетку, а продукты жизнедеятельности – мочевина
– удаляются из клетки во внешнюю среду.
Тесно связана с обменом веществ, однако здесь мне особенно хочется подчеркнуть варианты транспорта веществ через клетку.
Выделяется два вида транспорта:
Внутрь клетки с помощью осмоса поступает вода. Путем простой диффузии в клетку попадают O2, H2O,
CO2, мочевина. Облегченная диффузия характерна для транспорта глюкозы, аминокислот.
Активный транспорт чаще происходит против градиента концентрации, в ходе него используются белки-переносчики и
энергия АТФ. Ярким примером является натрий-калиевый насос, который накачивает ионы калия внутрь клетки, а ионы
натрия выводит наружу. Это происходит против градиента концентрации, поэтому без затрат энергии (АТФ) не обойтись.
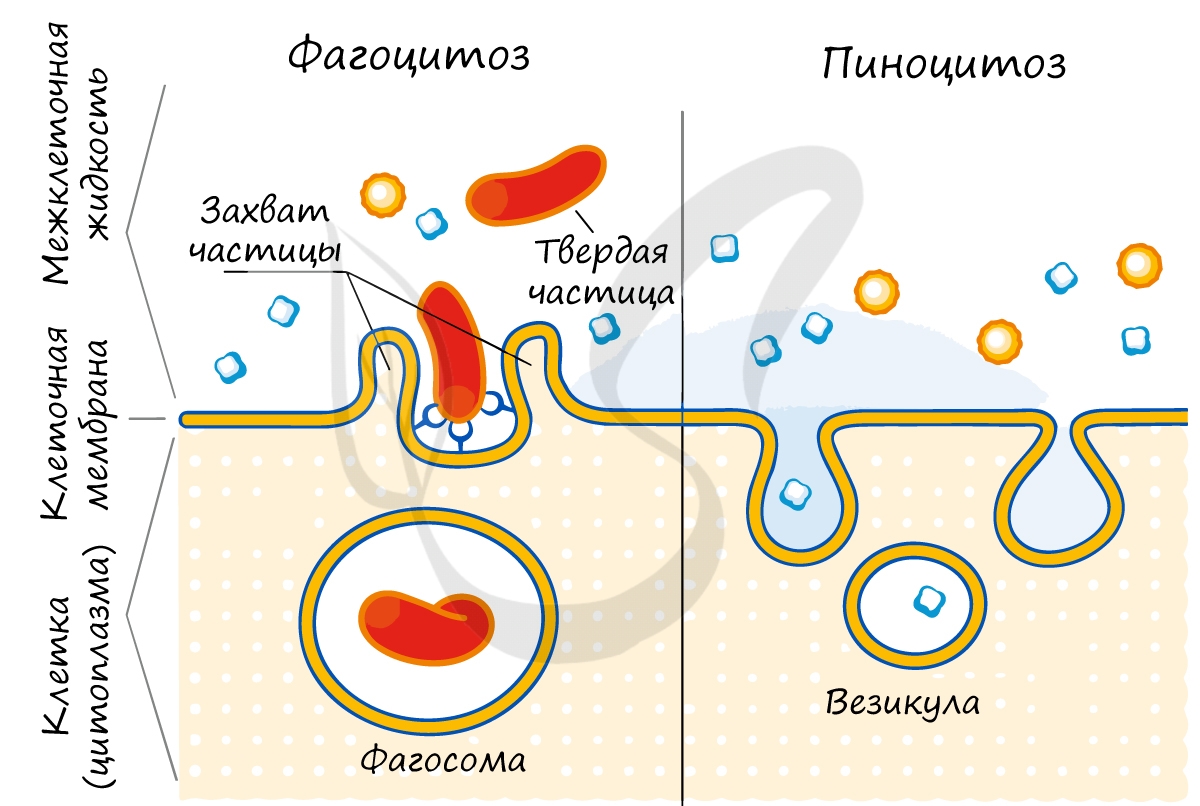
Внутрь клетки крупные молекулы попадают путем эндоцитоза (греч. endo — внутрь) двумя путями:
- Фагоцитоз (греч. phago – ем + cytos – клетка) – поглощение твердых пищевых частиц и бактерий фагоцитами
- Пиноцитоз (греч. pino – пью) – поглощение клеткой жидкости, захват жидкости клеточной поверхностью
Фагоцитоз был открыт И.И. Мечниковым, который создал фагоцитарную теорию иммунитета. Это теория гласит, что в основе иммунной системы
нашего организма лежит явление фагоцитоза: попавшие в организм бактерии уничтожаются фагоцитами (T-лимфоцитами), которые переваривают их.
В ходе эндоцитоза мембрана сильно прогибается внутрь клетки, ее края смыкаются, захватывая бактерию, пищевые частицы или жидкость внутрь
клетки. Образуется везикула (пузырек), который движется к пищеварительной вакуоли или лизосоме, где происходит внутриклеточное
пищеварение.
Клетки многих органов, к частности эндокринных желез, которые выделяют в кровь гормоны, транспортируют синтезированные вещества к
мембране и удаляют их из клетки с помощью экзоцитоза (от др.-греч. ἔξω – вне, снаружи). Таким образом, процессы экзоцитоза и
эндоцитоза противоположны.
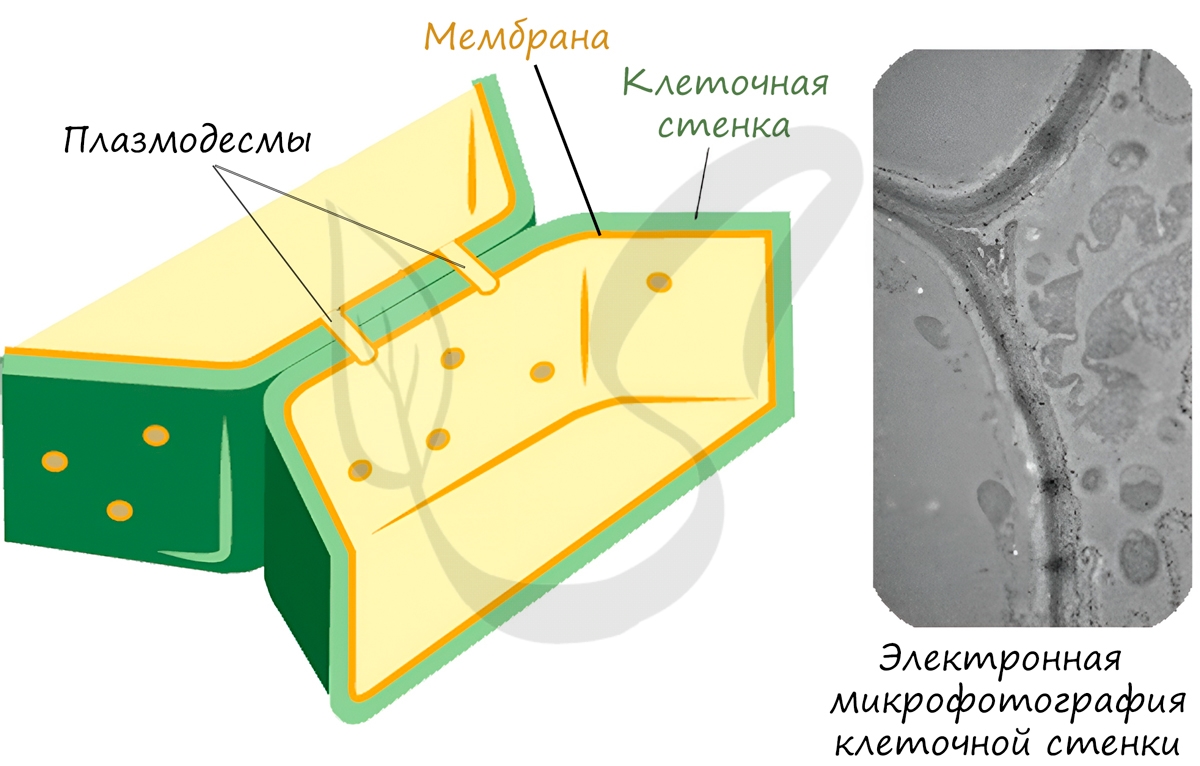
Клеточная стенка
Расположена снаружи клеточной мембраны. Присутствует только в клетках бактерий, растений и грибов, у животных отсутствует.
Придает клетке определенную форму, направляет ее рост, придавая характерное строение всему организму.
Клеточная стенка бактерий состоит из полимера муреина, у грибов – из хитина, у растений – из целлюлозы.
Цитоплазма
Органоиды клетки расположены в цитоплазме, которая состоит из воды, питательных веществ и продуктов обмена. В цитоплазме
происходит постоянный ток веществ: поступившие в клетку вещества для расщепления необходимо доставить к органоидам, а побочные продукты – удалить из клетки.
Постоянное движение цитоплазмы поддерживает связь между органоидами клетки и обеспечивает ее целостность.
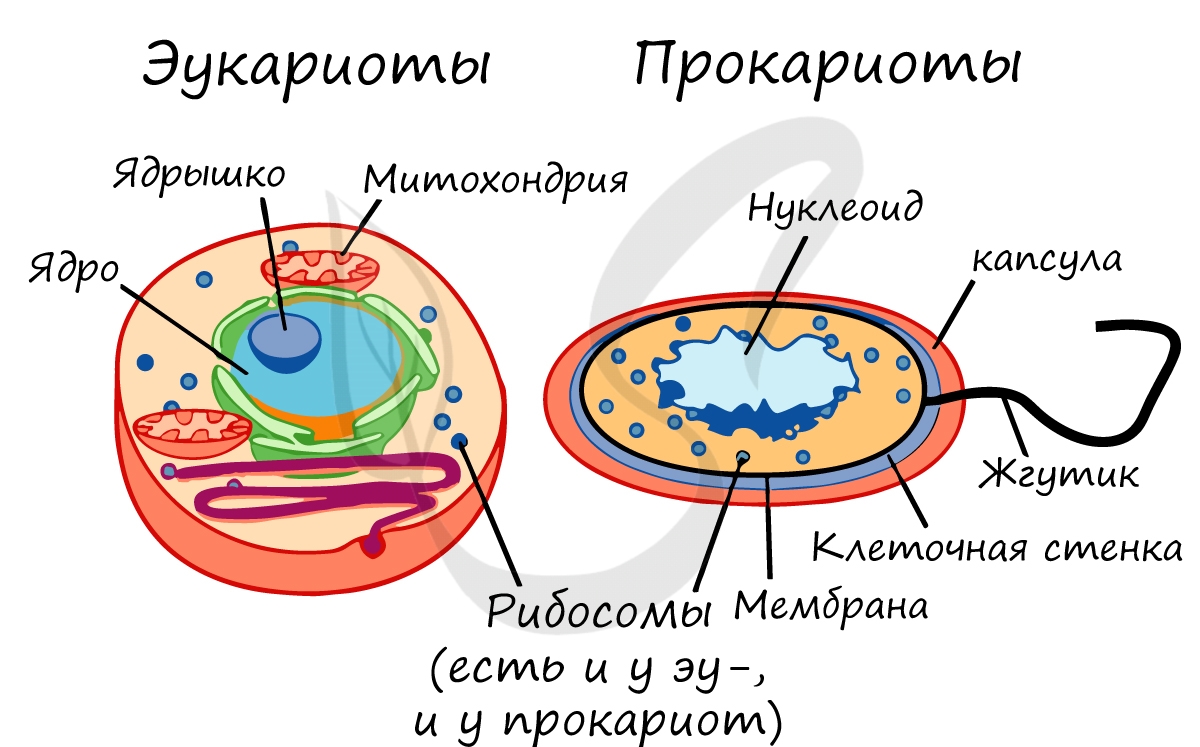
Прокариоты и эукариоты
Прокариоты (греч. πρό – перед и κάρυον – ядро) или доядерные – одноклеточные организмы, не обладающие в отличие от
эукариот оформленным ядром и мембранными органоидами. У прокариот могут обнаруживаться только немембранные органоиды.
Их генетический материал представлен в виде кольцевой молекулы ДНК – нуклеоида. К прокариотам относятся бактерии
(в их числе цианобактерии), археи.
Эукариоты (греч. εὖ – хорошо + κάρυον – ядро) или ядерные – домен живых организмов, клетки которых содержат оформленное
ядро. Растения, животные, грибы – относятся к эукариотам.
Немембранные органоиды
- Рибосома
- Микротрубочки и микрофиламенты
- Клеточный центр (центросома, от греч. soma – тело)
- Реснички и жгутики
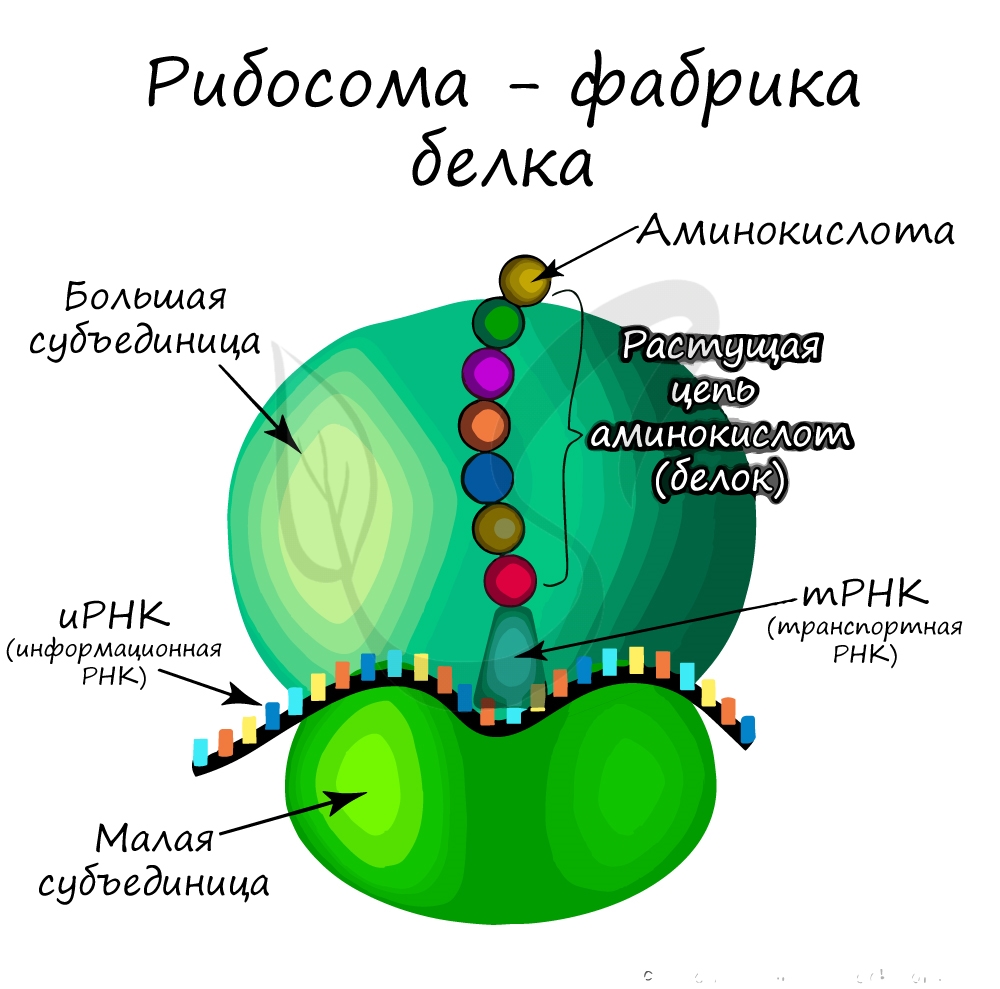
Очень мелкая органелла (около 20 нм), которая была открыта после появления электронного микроскопа.
Состоит из двух субъединиц: большой и малой, в состав которых входят белки и рРНК (рибосомальная РНК), синтезируемая
в ядрышке.
Запомните ассоциацию: “Рибосома – фабрика белка”. Именно здесь в ходе матричного биосинтеза – трансляции, с которой
подробнее мы познакомимся в следующих статьях, на базе иРНК (информационной РНК) синтезируется белок – последовательность
соединенных аминокислот в заданном иРНК порядке.
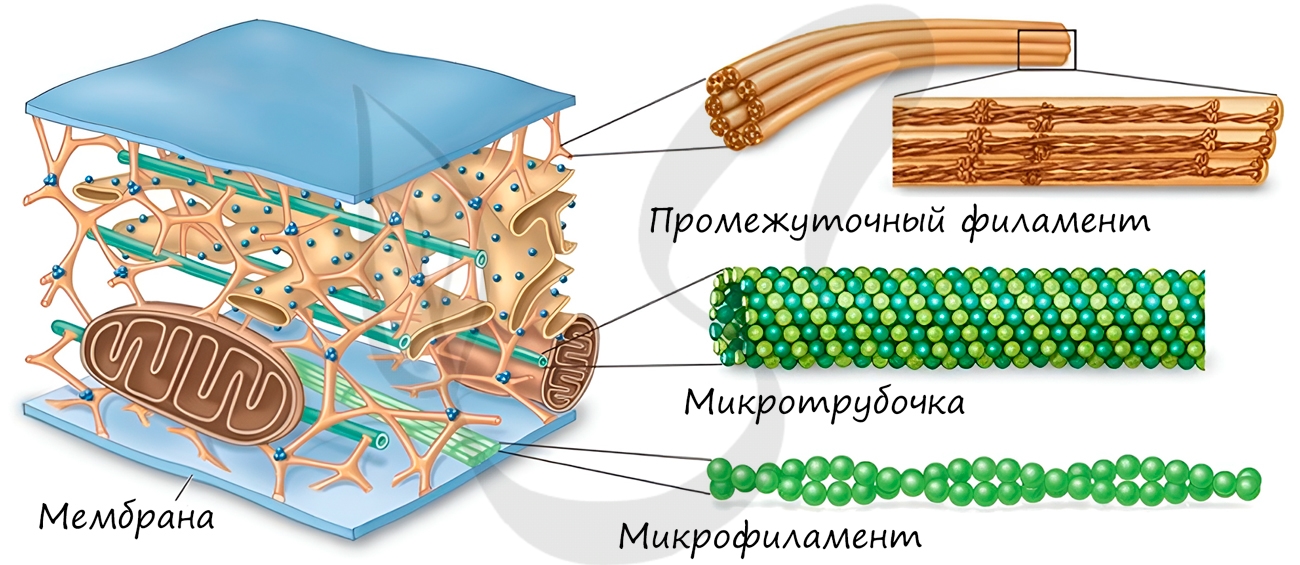
Микротрубочки являются внутриклеточными белковыми производными, входящими в состав цитоскелета. Они поддерживают
определенную форму клетки, участвуют в процессе деления путем образования нитей веретена деления. Микротрубочки
также образуют основу органоидов движения: жгутиков и ресничек.
Микрофиламенты – тонкие длинные нитевидные структуры, состоящие из белка актина. Встречаются во всей цитоплазме,
служат для создания тока цитоплазмы, принимают участие в движении клетки, в процессах эндо- и экзоцитоза.
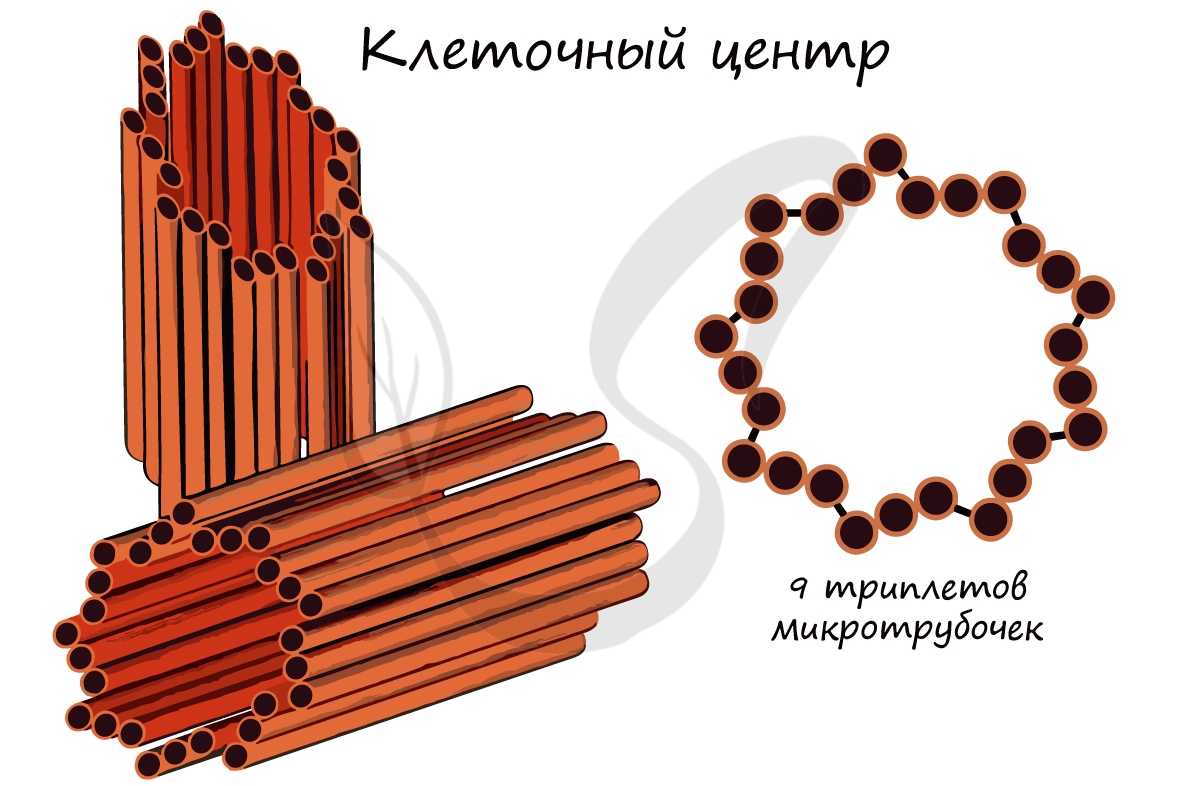
Этот органоид характерен только для животной клетки, в клетках грибов и высших растений отсутствует. Клеточный
центр состоит из 9 триплетов микротрубочек (триплет – три соединенных вместе). Участвует в образовании нитей веретена деления,
располагается на полюсах клетки.
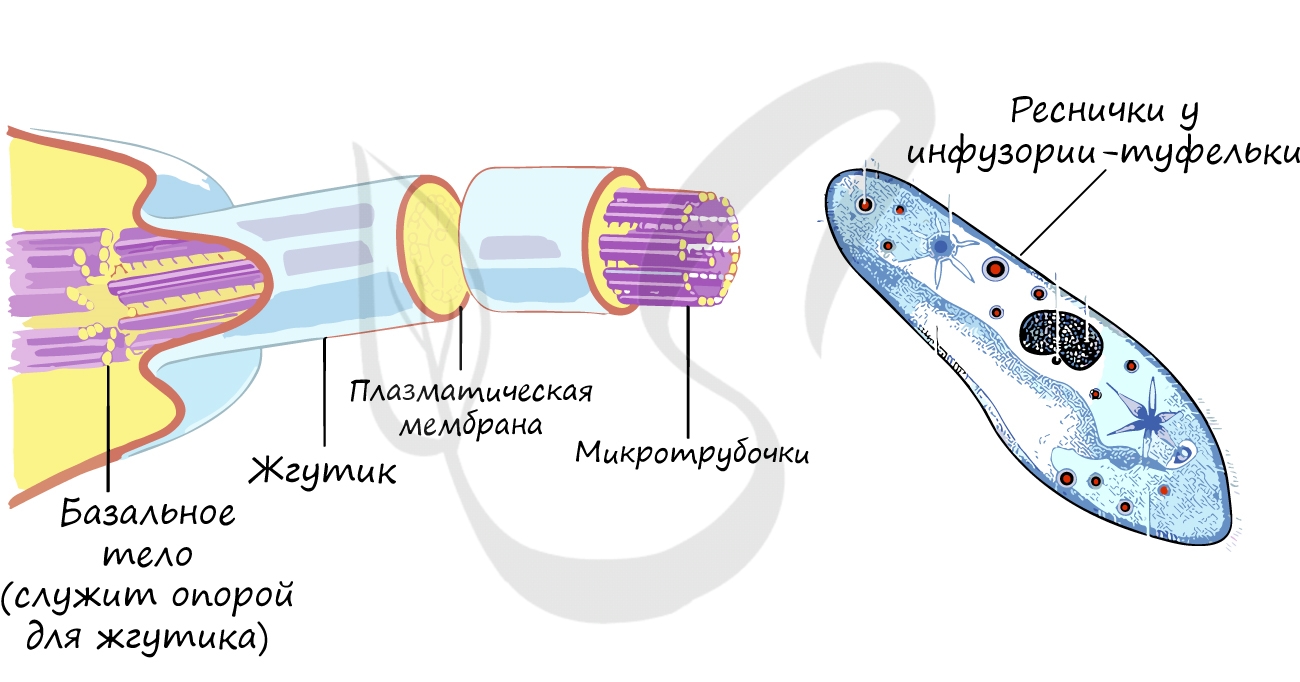
Это органоиды движения, которые выступают над поверхностью клетки и имеют в основе пучок микротрубочек.
Реснички встречаются только в клетках животных, жгутики можно обнаружить у животных, растений и бактерий.
Одномембранные органоиды
- Эндоплазматическая сеть (ЭПС), эндоплазматический ретикулум (лат. reticulum – сеть)
- Комплекс (аппарат) Гольджи
- Лизосома (греч. lisis – растворение + soma – тело)
- Пероксисомы (лат. per — сверх, греч. oxys — кислый и soma — тело)
- Вакуоли
ЭПС представляет собой систему мембран, пронизывающих всю клетку и разделяющих ее на отдельные изолированные части
(компартменты). Это крайне важно, так как в разных частях клетки идут реакции, которые могут помешать друг другу,
что нарушит процессы жизнедеятельности.
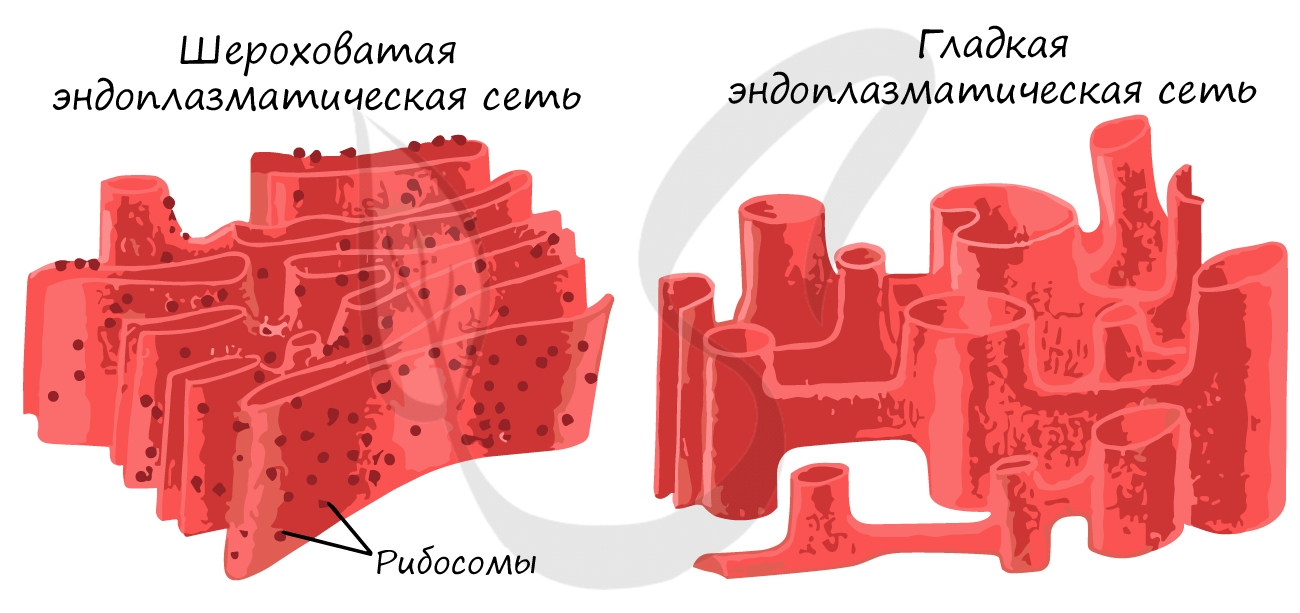
Выделяют гладкую ЭПС и шероховатую ЭПС. Обе они выполняют функцию внутриклеточного транспорта веществ, однако между ними
имеются различия. На мембранах гладкой ЭПС происходит синтез липидов, обезвреживаются вредные вещества. Шероховатая
ЭПС синтезирует белок, так как имеет на мембранах многочисленные рибосомы (потому и называется шероховатой).
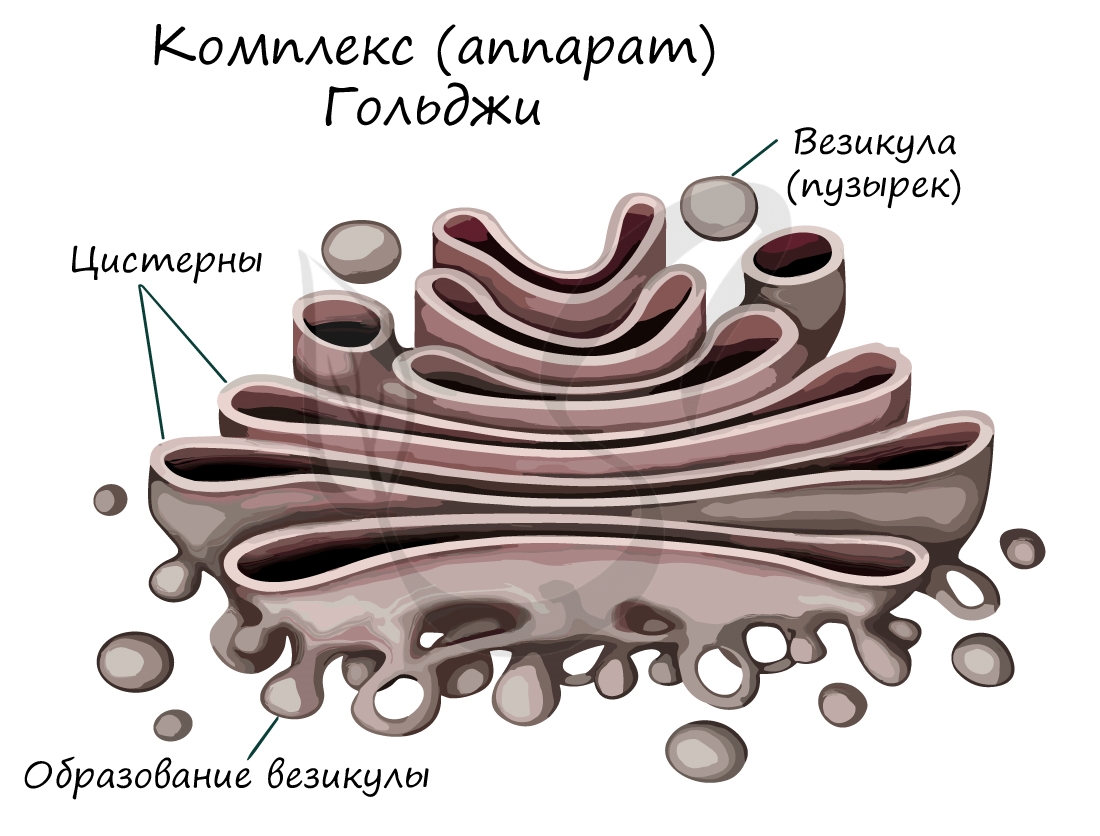
Комплекс Гольджи состоит из трубочек, сети уплощенных канальцев (цистерн) и связанных с ними пузырьков. Располагается
вокруг ядра клетки, внешне напоминает стопку блинов. Это – “клеточный склад”. В нем запасаются жиры и углеводы, с
которыми здесь происходят химические видоизменения.
Модифицированные вещества упаковываются в пузырьки и могут перемещаться к мембране клетки, соединяясь с ней, они
изливают свое содержимое во внешнюю среду. Можно догадаться, что комплекс Гольджи хорошо развит в клетках
эндокринных желез, которые в большом количестве синтезируют и выделяют в кровь гормоны.
В комплексе Гольджи появляются первичные лизосомы, которые содержат ферменты в неактивном состоянии.
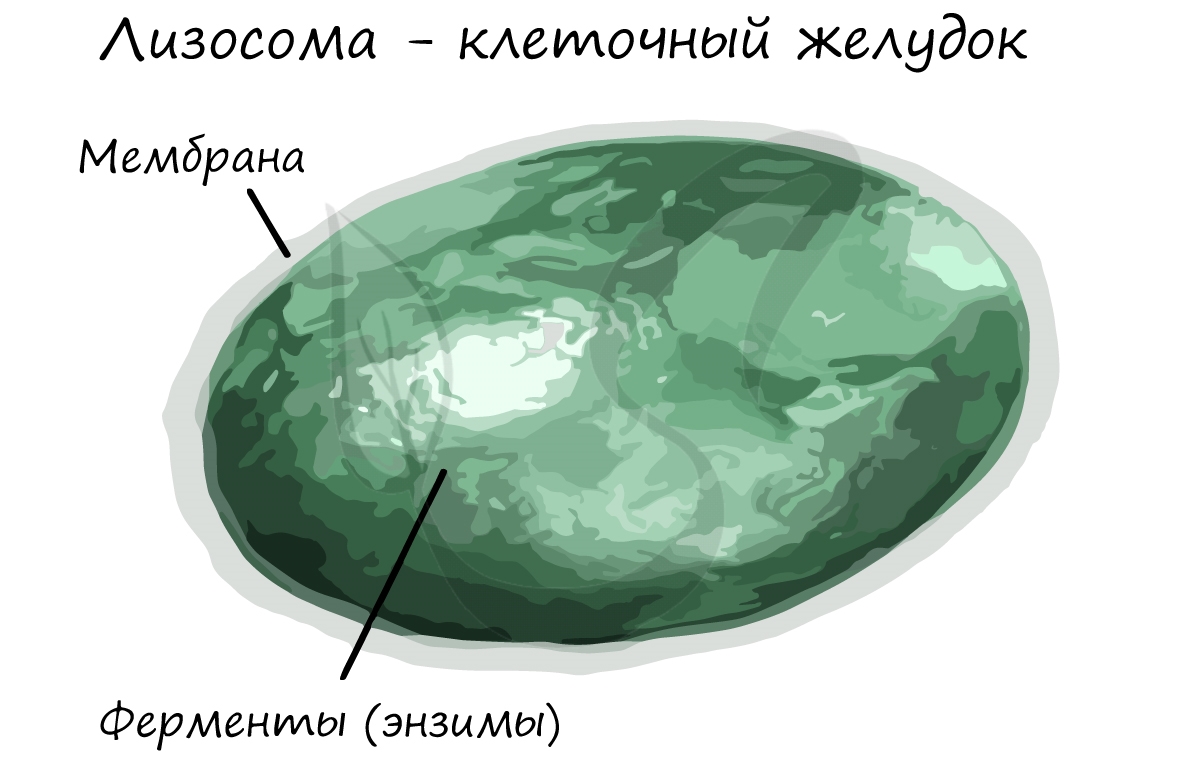
Представляет собой мембранный пузырек, содержащий внутри ферменты (энзимы) – липазы, протеазы, фосфатазы.
Лизосому можно ассоциировать с “клеточным желудком”.
Лизосома участвует во внутриклеточном пищеварении поступивших в клетку веществ. Сливаясь с фагосомой, первичная лизосома превращается во вторичную, ферменты активируются. После расщепления веществ образуется остаточное тельце – вторичная лизосома с непереваренными остатками, которые удаляются из клетки.

Лизосома может переварить содержимое фагосомы (самое безобидное), переварить часть клетки или всю клетку целиком.
В норме у каждой клетки жизненный цикл заканчивается апоптозом – запрограммированным процессом клеточной гибели.
В ходе апоптоза ферменты лизосомы изливаются внутрь клетки, ее содержимое переваривается. Предполагают, что
нарушение апоптоза в раковых клетках ведет к бесконтрольному росту опухоли.
Пероксисомы (микротельца) содержат окислительно-восстановительные ферменты, которые разлагают H2O2
(пероксид водорода) на воду и кислород. Если бы пероксид водорода оставался неразрушенными, это приводило бы
к серьезным повреждениям клетки.
Вакуоли характерны для растительных клеток, однако встречаются и у животных (у одноклеточных – сократительные
вакуоли). У растений вакуоли выполняют другие функции и имеют иное строение: они заполняются клеточным соком, в котором
содержится запас питательных веществ. Снаружи вакуоль окружена тонопластом.
Трудно переоценить значение вакуолей в жизнедеятельности растительной клетки. Вакуоли создают осмотическое давление,
придают клетке форму.
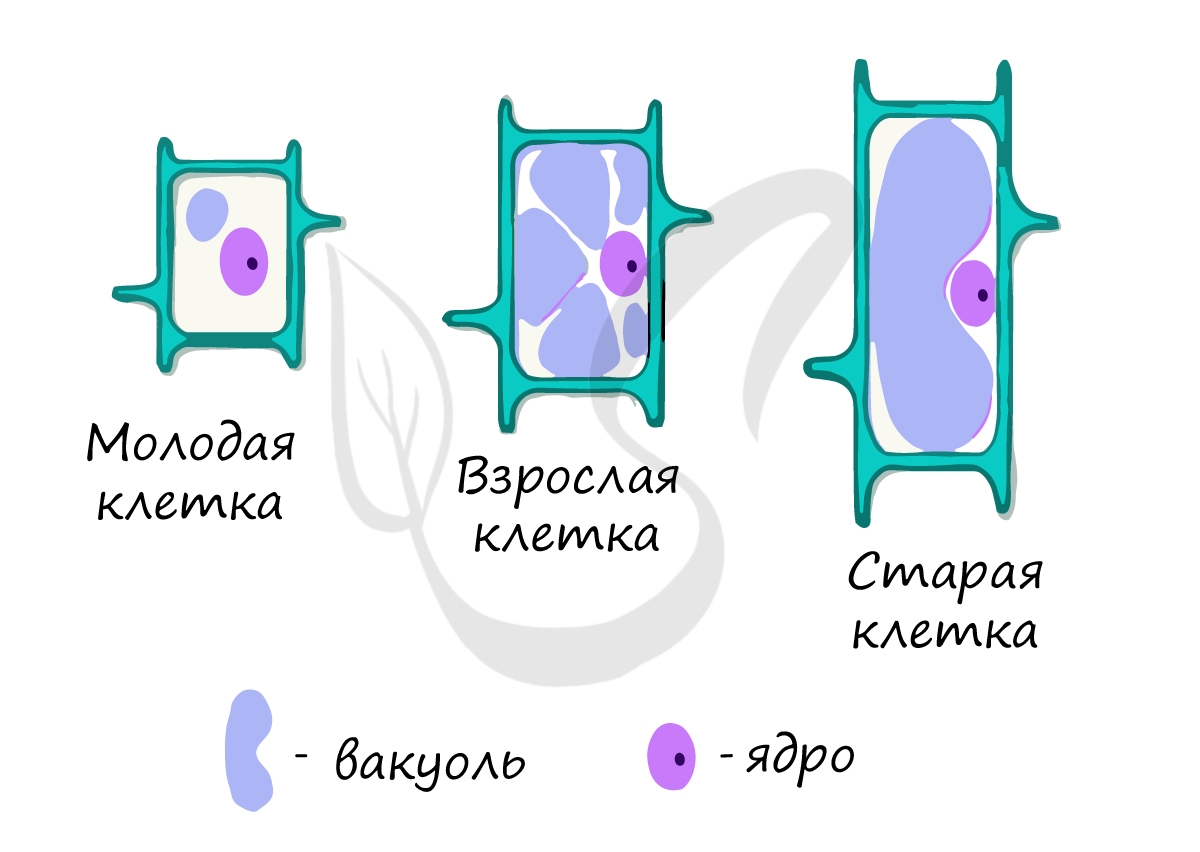
Примечательно, что по размеру вакуолей можно судить о возрасте клетки: молодые клетки имеют
вакуоли небольшого размера, а в старых клетках вакуоли могут настолько увеличиваться, что оттесняют ядро и остальные
органоиды на периферию.
Двумембранные органоиды
- Ядро (“ядро” по лат. – nucleus, по греч. – karyon)
- Митохондрия
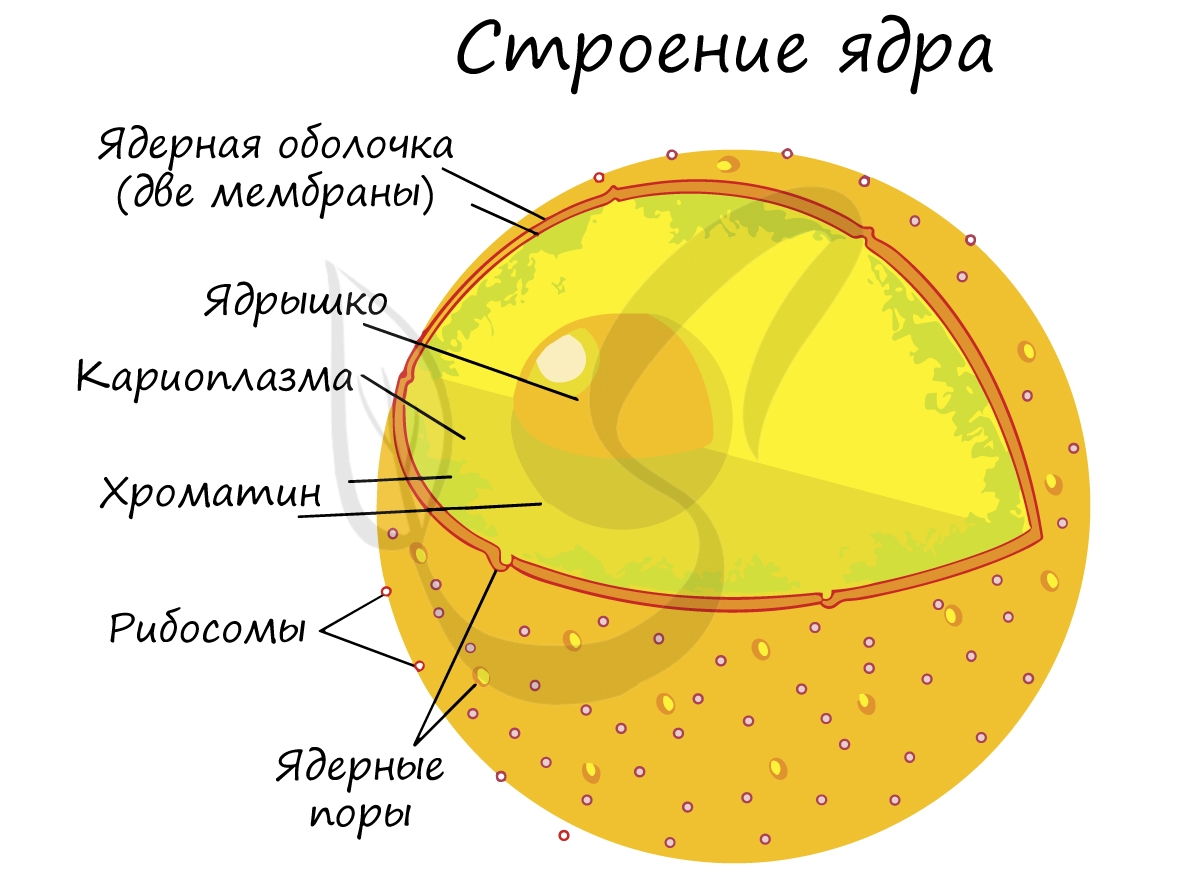
Важнейший компонент эукариотической клетки – оформленное ядро, которое у прокариот отсутствует. Внутренняя часть
ядра представлена кариоплазмой, в которой расположен хроматин – комплекс ДНК, РНК и белков, и одно или несколько
ядрышек.
Ядрышко – место в ядре, где активно идет процесс матричного биосинтеза – транскрипция, с которым мы познакомимся
подробнее в следующих статьях. В течение дня, наблюдая за одной и той же клеткой, можно увидеть разное количество
ядрышек или не найти ни одного.
Оболочка ядра состоит из двух мембран и пронизана большим количеством ядерных пор, через которые происходит сообщение
между кариоплазмой и цитоплазмой. Главными функциями ядра является хранение, защита и передача наследственного материала
дочерним клеткам.
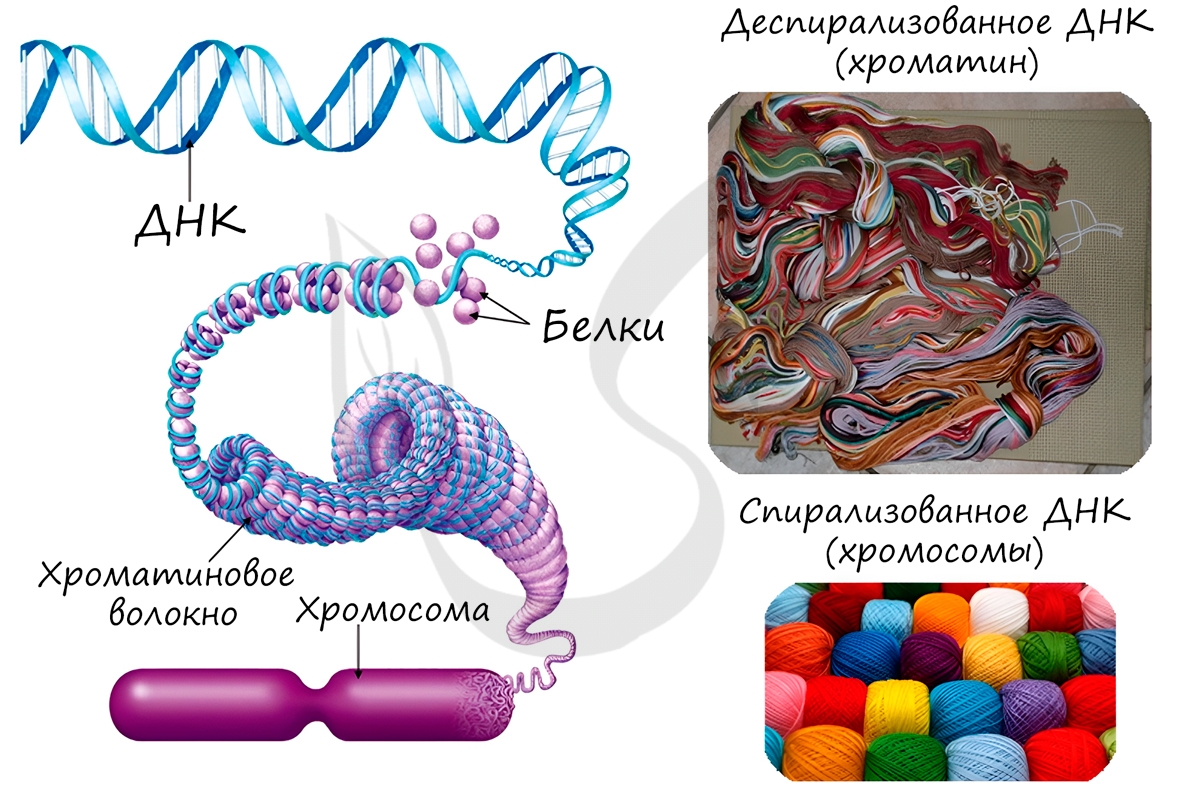
Замечу, что хромосомы видны только в момент деления клетки. Хромосомы представляют собой сильно спирализованные молекулы
ДНК, связанные с белками.
Я всегда рекомендую ученикам ассоциировать хромосому с мотком ниток: если все нитки обмотать
вокруг одной оси, то они становятся мотком и хорошо видны (хромосомы – во время деления, спирализованное ДНК), если же клетка не
делится, то нитки размотаны и разбросаны в один слой, хромосом не видно (хроматин – деспирализованное ДНК).
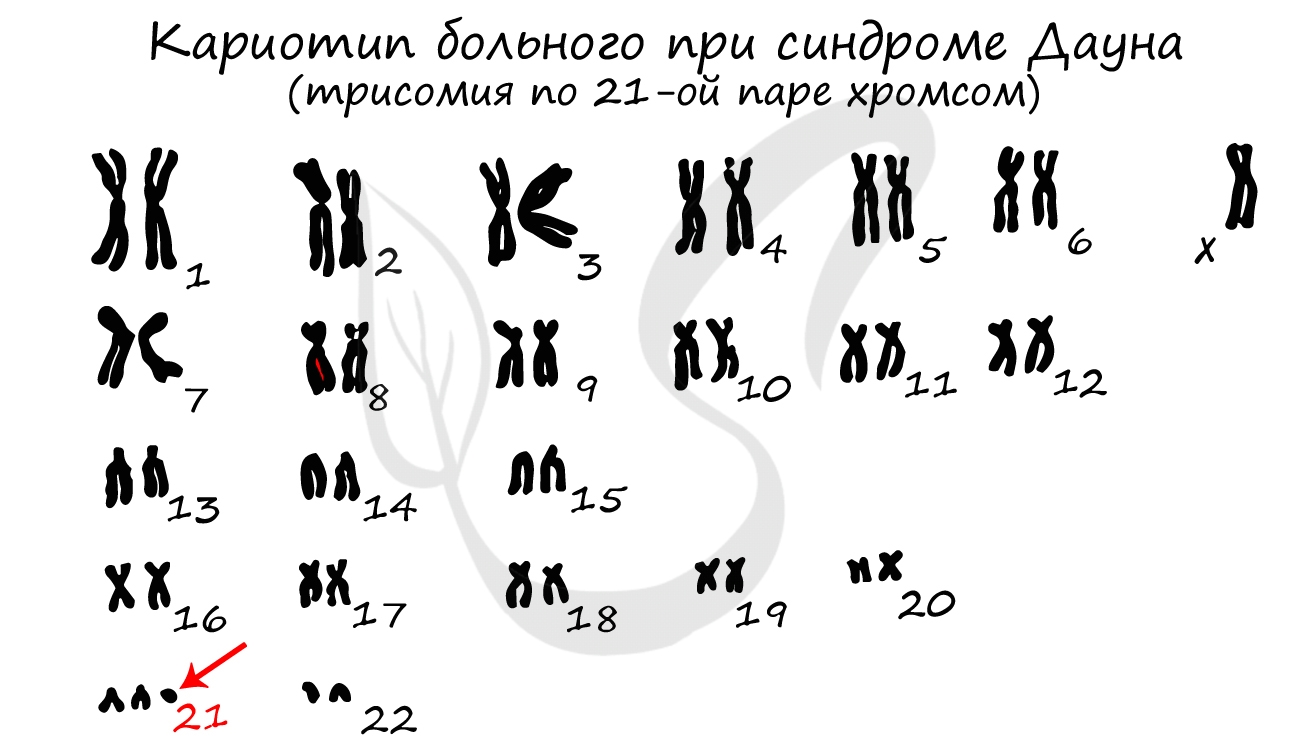
Хромосомы отличаются друг от друга по строению, форме, размерам. Совокупность всех признаков (форма, число, размер) хромосом
называется кариотип. Кариотип может быть представлен по-разному: существует кариотип вида, особи, клетки.
Изучая кариотип человека, врач-генетик может обнаружить различные наследственные заболевания, к примеру, синдром Дауна – трисомия по 21-ой паре хромосом (должно быть 2 хромосомы, однако при синдроме Дауна их три).
Органоид палочковидной формы. Митохондрию можно сравнить с “энергетической станцией”. Если в цитоплазме происходит
анаэробный этап дыхания (бескислородный), то в митохондрии идет более совершенный – аэробный этап (кислородный). В
результате кислородного этапа (цикла Кребса) из двух молекул пировиноградной кислоты (образовавшихся из 1 глюкозы)
получаются 36 молекул АТФ.
Митохондрия окружена двумя мембранами. Внутренняя ее мембрана образует выпячивания внутрь – кристы, на которых имеется
большое скопление окислительных ферментов, участвующих в кислородном этапе дыхания. Внутри митохондрия заполнена
матриксом.
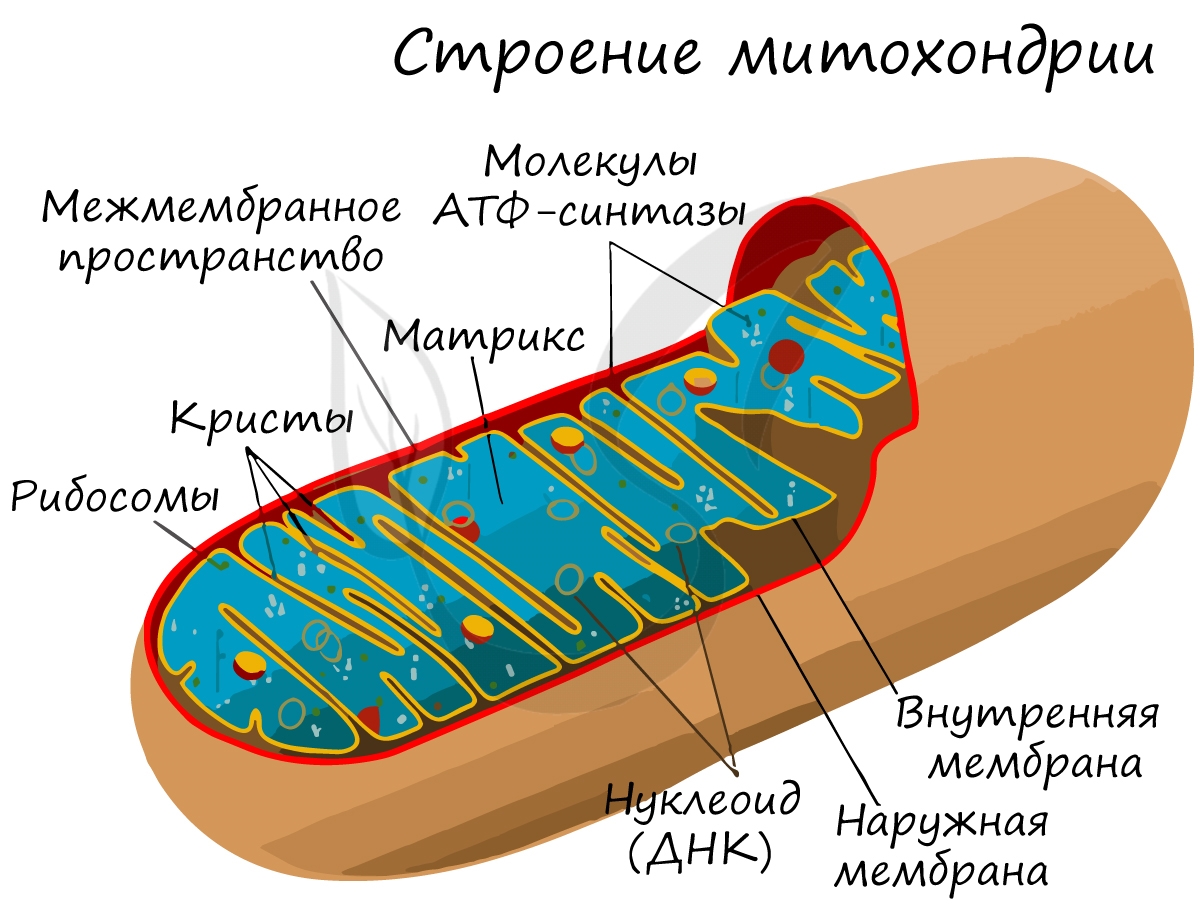
Запомните, что особенностью этого органоида является наличие кольцевой молекулы ДНК – нуклеоида, и рибосом. То есть
митохондрия обладает собственным генетическим материалом и возможностью синтеза белка, почти как отдельный организм.
В связи с этим, митохондрия считается полуавтономным органоидом. Вероятнее всего, изначально митохондрии были
самостоятельными организмами, однако со временем вступили в симбиоз с эукариотами и стали частью клетки.
Митохондрий особенно много в клетках мышц, в том числе – в серд
