В каких реакциях проявляются слабокислотные свойства фенола

Фенолами называются соединения общей формулы АrОН, где Аr-фенил, замещенный фенил или одна из других арильных групп (например нафтил). Фенолы отличаются от спиртов тем, что ОН-группа в феноле связана непосредственно с ароматическим кольцом:
ОН ОН ОН ОН ОН
ОН
фенол м-крезол пирокатехин резорцин гидрохинон
СН3 ОН
ОН
Фенолы проявляют кислотные свойства и образуют фенолята с основаниями. Кислый характер гидроксилной группы у фенола обусловлен влиянием бензольного кольца. В свою очередь, гидроксильная группа сильно увеличивает реакционную способность бензольного кольца (заменитель 1 рода).
Для нафтолов характерны обычные реакции фенолов. Реакция сочетания с солями диазония особенно важна в производстве красителей.
1. Слабокислотные свойства.Всем фенолам присущи слабокислые свойства, что проявляется в их способности растворяться в щелочах с образованием фенолята:
C6H5OH + NaOH → C6H5ONa + H2O.
Кислотные свойства фенолов выражены очень слабо. Так, фенолы не окрашивают лакмусовую бумагу. Самая слабая неорганическая кислота – угольная – вытесняет фенолы из их солеобразных соединений – фенолятов:
C6H5ONa + H2CO3 → C6H5OH↓ + NaHCO3.
Исходя из констант диссоциации, кислотные свойства фенола выражены в 3300 раз более, чем у угольной кислоты.
Кислотные свойства фенольного гидроксила (по сравнению со спиртовым) объясняются тем, что в фенольном гидроксиле свободная пара электронов кислорода взаимодействует с π-электронами бензольного кольца, сдвигаясь в сторону кольца. Атом кислорода, так как его отрицательный заряд уменьшается, а положительный вследствие этого несколько увеличивается, сильнее притягивает к себе электрон от атома водорода из гидроксила; это облегчает отщепление водорода в виде протона, т. е. диссоциацию:
– O – H – O- + H+.
2. Образование простых эфиров.Фенолы, подобно спиртам, способны давать соединения типа простых эфиров. Практически для получения простых эфиров фенолов на феноляты действуют гелогеналкинами (а) или галогенарилами (б):
а) C6H5О Na + I C2H5 → C6H5 – O – C2H5 + NaI;
б) C6H5O Na + Br C6H5 → C6H5 – O – C6H5 + NaBr.
В первом случае (а) получается простой эфир, содержащий радикал фенола и радикал спирта, т. е. смешанный жирноароматический простой эфир. Во втором случае (б) получается простой эфир, содержащий два остатка фенола, т. е. ароматический простой эфир.
3. Образование сложных эфиров.Подобно спиртам фенолы могут давать соединения типа сложных эфиров. Практически для получения сложных эфиров фенолов обычно на феноляты действуют галогенангидридами кислот, например:
C6H5ONa + Cl – C – CH3 → C6H5 – O – C – CH3 + NaCl.
O O
Фенолы дают сложные эфиры как с органическими, так и с минеральными кислотами.
4. Реакция окрашивания с хлорным железом.Все фенолы с хлорным железом образуют окрашенные соединения; одноатомные фенолы обычно дают окрашивание фиолетового или синего цвета.
5. Замещение атомов водорода в бензольном ядре. Остаток бензола в фенолах влияет на гидроксильную группу, сообщая ей кислотные свойства. И гидроксил, введенный в молекулу бензола, влияет на остаток бензола, увеличивая подвижность атомов водорода в бензольном ядре. В результате атомы водорода в ядре молекулы фенола замещаются гораздо легче, чем у бензола.
Замещение галогенами. При действии на фенолы галогенов, даже бромной воды, три атома очень легко замещаются и получаются тригалогенозамещенные фенолы:
OH
ОН
Br Br
+3Br2 + 3HBr
Br
Атомы брома замещают атомы водорода, находящиеся в орто- и пара-положении по отношению к гидроксильной группе.
Замещение остатком азотной кислоты. Фенолы очень легко нитрируются. Так, при действии даже очень разбавленной азотной кислоты получается смесь о- и n-нитрофенола:
OH
NO2
2 + 2HNO3 –OH + O2N– –OH +2Н2О
Замещение остатком серной кислоты. Фенолы легко сульфируются; из фенола при этом получается смесь о- и n-фенолсульфо-кислот:
OH OH OH
SO3H
2 + 2H2SO4 + + 2Н2О
SO3H
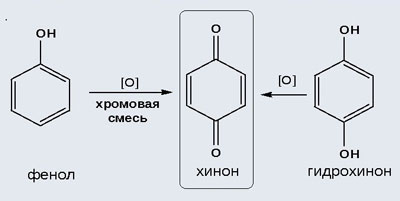
6. Окисление фенолов.Фенолы легко окисляются даже при действии кислорода воздуха. При этом они изменяют свой цвет, окрашиваясь в розовый, красно-розовый или темно-красный цвет. Примеси к фенолам ускоряют окисление и поэтому неочищенные фенолы обычно темнеют очень сильно и быстро.
Первой стадией при окислении фенолов является отщепление атома водорода от гидроксильной группы с образованием свободного феноксильного радикала с одновалентным кислородом. Эти радикалы далее вступают в различные сложные химические превращения, часто с образованием более крупных молекул.
При более энергичном окислении фенолов (например, хромовой смесью) наряду с окислением фенольного гидроксила окисляется атом водорода, находящийся в пара-положении по отношению к гидроксильной группе; при этом образуются бензохинон и продукты его дальнейших превращений:
H H
C = C
O = C C = O
C = C
H H
В условиях еще более энергичного окисления бензольное ядро фенолов разрушается.
7. Антисептические свойства.Фенолы убивают многие микроорганизмы. Это свойство используют в медицине, применяя фенолы и их производные как дезинфицирующие и антисептические средства. Фенол (карболовая кислота) был превым антисептическим средством, введенным в хирургию Листером в 1867 г. Антисептические свойства фенолов основаны на их способности свертывать белки.
Гомологи фенола – крезолы – обладают более сильным бактерии-цидным действием, чем сам фенол.
Антисептическое действие различных антисептических средств часто сравнивают с таковым фенола. «Фенольный коэффициент» – число, показывающее, во сколько раз антисептическое действие данного вещества больше (или меньше) действия фенола, принимаемого за единицу.
Путем введения в молекулы фенолов различных заместителей – ато-мов галогена и т. д. – был получен ряд антисептических средств, более ценных, чем сам фенол.
Итак, в данном разделе разработаны химические и антисептические свойства фенолов и нафтолов.
[1, с. 130−132; 3, с. 112−126; 5, с. 389−397].
Рекомендуемые страницы:
Источник
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: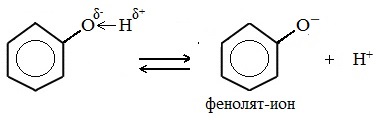
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: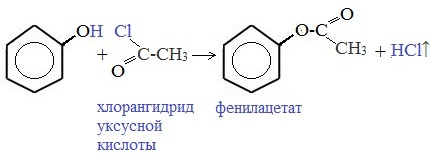
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
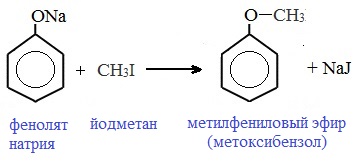
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
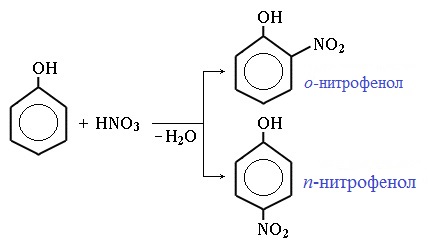
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):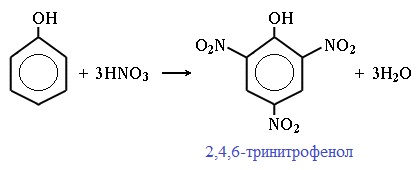
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):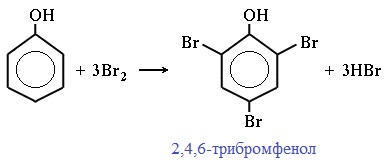
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: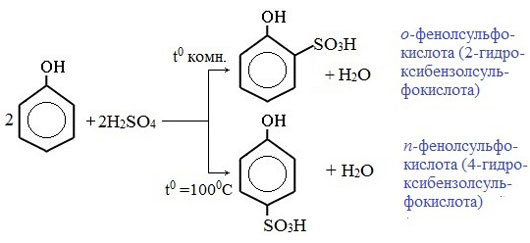 Реакции присоединения
Реакции присоединения
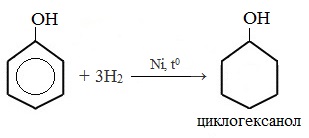
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! – обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
Источник
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.

Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:

В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

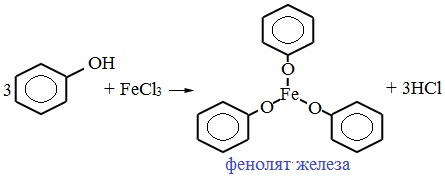
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 декабря 2020; проверки требует 1 правка.
| Фенол | |
|---|---|
| Систематическое наименование | Гидроксибензол |
| Традиционные названия | Фенол, Карболовая кислота, карболка, бензолол; оксибензол |
| Хим. формула | C6H5OH |
| Рац. формула | C6H6O |
| Состояние | бесцветные кристаллы |
| Молярная масса | 94,11 г/моль |
| Плотность | 1,07 г/см³ |
| Энергия ионизации | 8,5 ± 0,1 эВ[1] |
| Температура | |
| • плавления | 40,9 °C |
| • кипения | 181,84 °C |
| • вспышки | 79 (в закрытом тигле), 85 (в открытом) °C |
| Пределы взрываемости | 1,8 ± 0,1 об.%[1] |
| Мол. теплоёмк. | 134,7 (кр.) Дж/(моль·К) |
| Энтальпия | |
| • образования | −162,944 кДж/моль |
| Давление пара | 0,4 ± 0,1 мм рт.ст.[1] |
| Константа диссоциации кислоты | 9,89 ± 0,01[2] |
| Растворимость | |
| • в воде | 6,5 г/100 мл |
| Гибридизация | sp2 |
| Рег. номер CAS | 108-95-2 |
| PubChem | 996 |
| Рег. номер EINECS | 203-632-7 |
| SMILES | OC1=CC=CC=C1 |
| InChI | InChI=1S/C6H6O/c7-6-4-2-1-3-5-6/h1-5,7H ISWSIDIOOBJBQZ-UHFFFAOYSA-N |
| RTECS | SJ3325000 |
| ChEBI | 15882 |
| ChemSpider | 971 |
| ЛД50 | 140 мг/кг (морская свинка, внутрижелудочно) |
| Токсичность | токсичен, весьма едкий, является сильным ирритантом |
| Фразы риска (R) | R23/24/25, R34, R48/20/21/22, R68 |
| Фразы безопасности (S) | S24/25, S26, S28, S36/37/39, S45 |
| Краткие характер. опасности (H) | H301, H311, H331, H314, H341, H373 |
| Меры предостор. (P) | P260, P301+P310, P303+P361+P353, P305+P351+P338, P361, P405, P501 |
| Сигнальное слово | опасно |
| Пиктограммы СГС | |
| NFPA 704 | 2 3 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Игольчатые кристаллы фенола
Фено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов.
Мировое производство фенола на 2006 год составляет 8,3 млн т/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ[источник не указан 823 дня]. Токсичен, сильный ирритант.
История[править | править код]
Фенол был обнаружен в 1834 году Фридлибом Фердинандом Рунге, который извлек его (в нечистом виде) из каменноугольной смолы[3]. Рунге назвал фенол «Karbolsäure» (угольно-масляная кислота, карболовая кислота). Каменноугольная смола оставалась основным источником получения фенола до развития нефтехимической промышленности. В 1841 году французский химик Огюст Лоран получил фенол в чистом виде[4].
В 1836 году Огюст Лоран придумал название «фон» для бензола[5] это корень слов «фенол» и «фенил». В 1843 году французский химик Шарль Герхардт придумал название «фенол»[6].
Антисептические свойства фенола использовал сэр Джозеф Листер (1827—1912) в своей пионерской технике антисептической хирургии. Листер решил, что сами раны должны быть тщательно очищены. Затем он покрыл раны кусочком тряпки или ворса[7], покрытого фенолом или «карболовой кислотой», как он её называл. Раздражение кожи, вызванное постоянным воздействием фенола, в конечном итоге привело к внедрению асептических методов в хирургию.
Получение[править | править код]
В настоящее время производство фенола в промышленном масштабе осуществляется тремя способами:
- кумольный метод. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол. 95 % всего производимого в мире фенола производят этим методом. Способ был изобретён советскими учёными П. Г. Сергеевым, Н. М. Горнасталевой, Р. Ю. Удрисом, Б. Д. Кружаловым. По сравнению с большинством других процессов, процесс кумола использует относительно мягкие условия синтеза и относительно недорогое сырье. Однако, чтобы работать экономно, должен быть спрос как на фенол, так и на ацетон[8][9]. В 2010 году мировой спрос на ацетон составлял примерно 6,7 миллиона тонн, 83 процента из которых были удовлетворены ацетоном, полученным кумольным методом;
- окисление толуола, с промежуточным образованием бензойной кислоты (около 3-х %);
- выделением из каменноугольной смолы.
Фенол также можно получить восстановлением хинона.
Физические свойства[править | править код]
Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол).
Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применявшийся в медицине в прошлом.
Химические свойства[править | править код]
Из-за наличия ароматического кольца и гидроксильной группы фенол проявляет химические свойства, характерные как для спиртов, так и для ароматических углеводородов.
По гидроксильной группе:
- Обладает слабыми кислотными свойствами (более сильными, чем у спиртов), при действии щелочей образует соли — феноляты (например, фенолят натрия — C6H5ONa)[10]:
Фенол — очень слабая кислота; даже угольная кислота вытесняет его из фенолятов:
Более интенсивно феноляты разлагаются под действием сильных кислот, например, серной:
Взаимодействие с металлическим натрием:
Фенол непосредственно не этерифицируется карбоновыми кислотами, эфиры можно получить при взаимодействии фенолятов с ангидридами или галогенангидридами кислот:
Образование простых эфиров. Для получения простых эфиров фенола действуют галогеналканами или галогенпроизводными аренов на феноляты. В первом случае получают смешанные жирно-ароматические простые эфиры:
Во втором случае получают чисто-ароматические простые эфиры:
Реакция проводится в присутствии порошкообразной меди, которая служит катализатором.
При перегонке фенола с цинковой пылью происходит замещение гидроксильной группы водородом[11]:
Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Гидроксогруппа, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения[12]. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
Взаимодействие с бромной водой (качественная реакция на фенол):
Образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
Взаимодействие с концентрированной азотной кислотой:
Взаимодействие с хлоридом железа(III) (качественная реакция на фенол[13]):
Реакция присоединения: гидрированием фенола в присутствии металлических катализаторов получают циклогексанол и циклогексанон:
Окисление фенола: вследствие наличия гидроксильной группы в молекуле фенола устойчивость к окислению намного ниже, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты. Так, под действием пероксида водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Биологическая роль[править | править код]
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы.
В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. В чистом виде фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение[править | править код]
По данным на 2006 год мировое потребление фенола имеет следующую структуру:
- 44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол;
- 30 % фенола расходуется на производство фенолформальдегидных смол;
- 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона[14];
- в России большое количество фенола используется в нефтепереработке, в частности для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу[15];
- остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство[16].
Фенол и его производные обусловливают консервирующие свойства коптильного дыма.
. В косметологии как химический пилинг (токсично).
- в скотоводстве: дезинфекция животных растворами фенола и его производных.
- в косметологии для проведения глубокого пилинга.
Токсические свойства[править | править код]
Фенол — токсичное вещество. По степени воздействия на человеческий организм фенол относится к высокоопасным веществам (Класс опасности 2). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют[17].
Предельно допустимые концентрации (ПДК) фенола[18][19][20][21]:
- ПДКр.з. = 1 мг/м³ (2 класс опасности)
- ПДКр.с. = 0,3 мг/м³ (2 класс опасности)
- ПДКм.р. = 0,01 мг/м³
- ПДКс.с. = 0,006 мг/м³
- ПДКв. = 0,001 мг/л.
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г[22].
Охрана труда[править | править код]
При ПДК в воздухе рабочей зоны 1 мг/м³ (максимально-разовая) и 0,3 мг/м³ (среднесменная). Порог восприятия запаха фенола у разных людей разный; и он может достигать (среднее значение в группе) 5,8-7,5 мг/м³[23]. А у отдельны
