В каких соединениях содержится азот

Азот – неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма – полуметалл, висмут – металл.
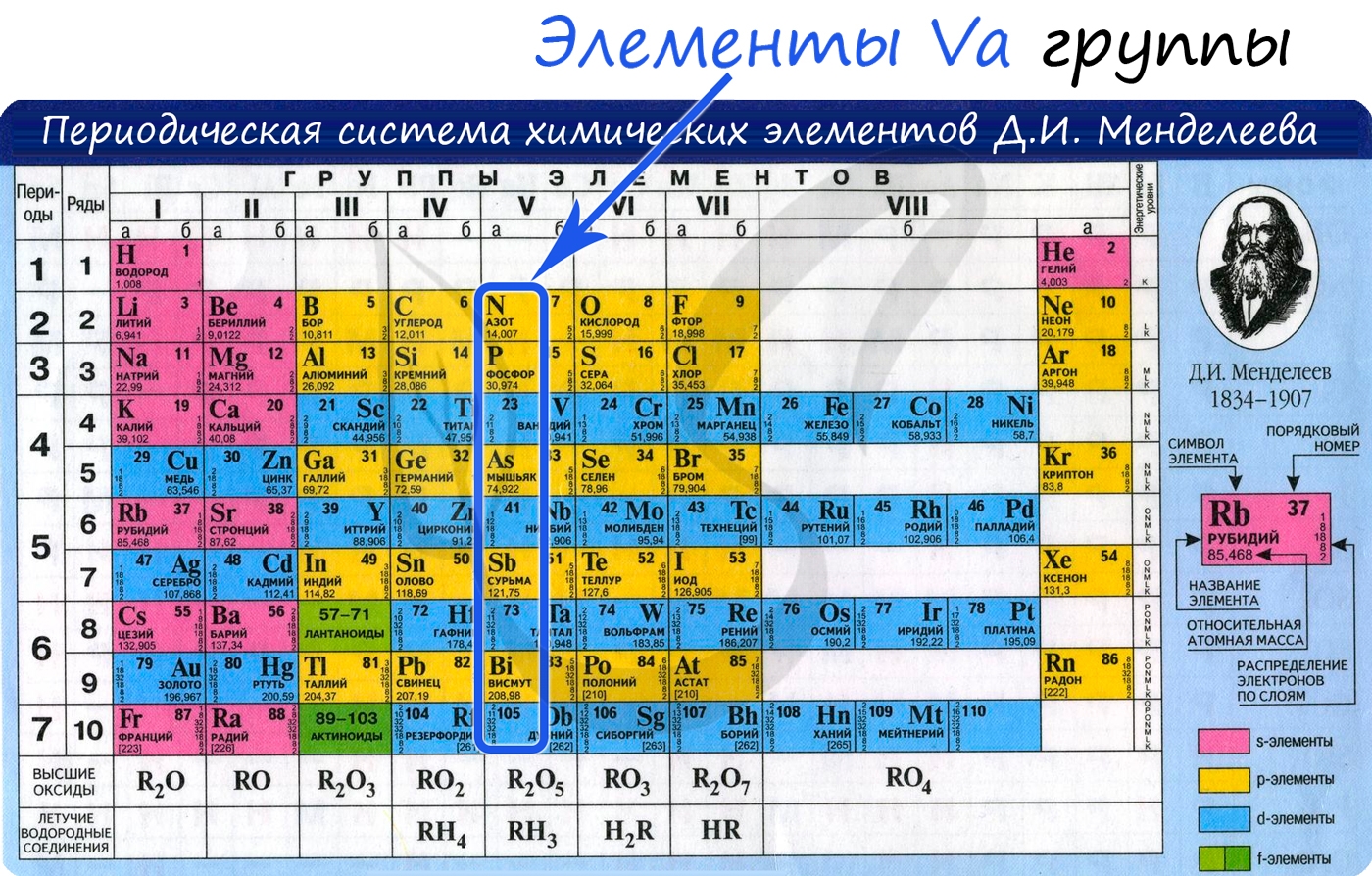
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N – 2s22p3
- P – 3s23p3
- As – 4s24p3
- Sb – 5s25p3
- Bi – 6s26p3
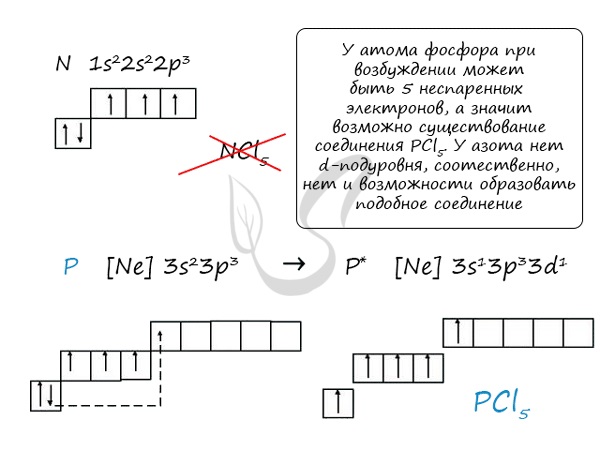
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно – возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух – во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 – индийская селитра, калиевая селитра
- NaNO3 – чилийская селитра, натриевая селитра
- NH4NO3 – аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
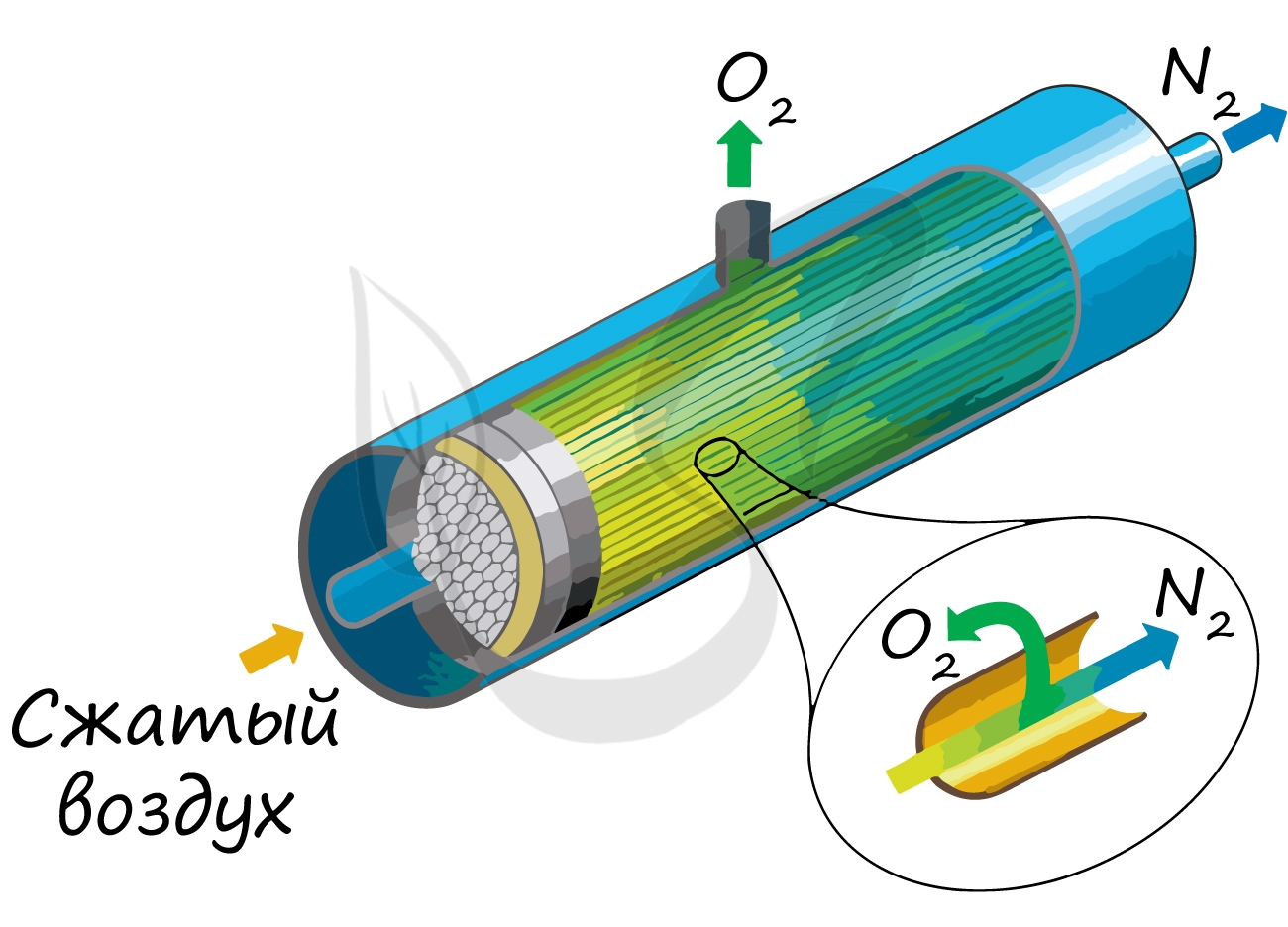
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает – он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
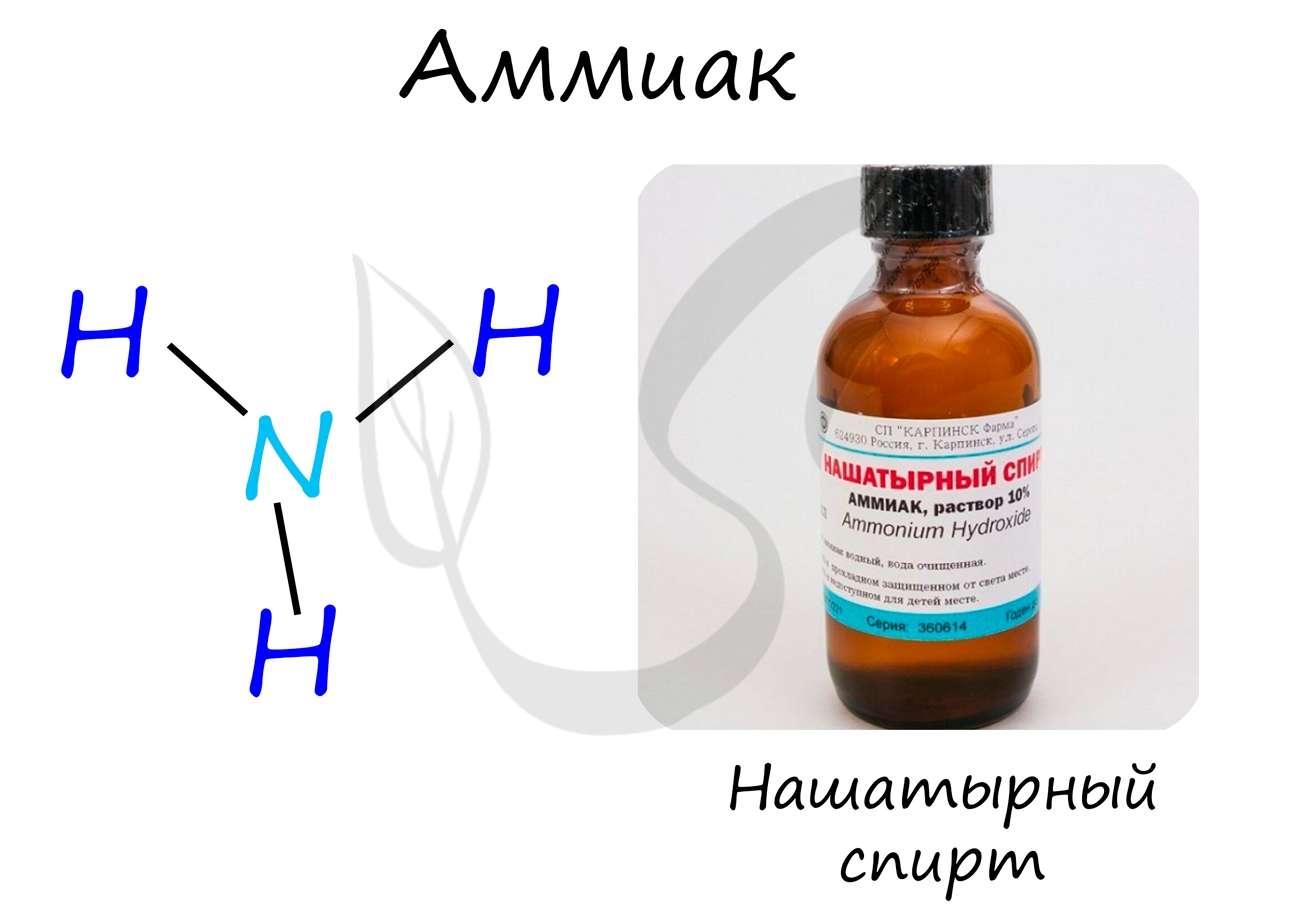
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение – гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода – реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония – NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I – N2O
Закись азота, веселящий газ – N2O – обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II – NO
Окись азота – NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях – в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа – оксида азота IV – NO2.
NO + O2 → NO2

Оксид азота III – N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем
охлаждением полученной смеси газов до температуры – 36 °C.
As2O3 + HNO3 → H3AsO4 + NO↑ + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислота – HNO2, соли которой называются нитриты (NO2-).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV – NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 – на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам – азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
- Обозначение – N (Nitrogen);
- Период – II;
- Группа – 15 (Va);
- Атомная масса – 14,00674;
- Атомный номер – 7;
- Радиус атома = 92 пм;
- Ковалентный радиус = 75 пм;
- Распределение электронов – 1s22s22p3;
- t плавления = -209,86°C;
- t кипения = -195,8°C;
- Электроотрицательность (по Полингу/по Алпреду и Рохову) = 3,04/3,07;
- Степень окисления: +5, +4, +3, +2, +1, 0, -1, -2, -3;
- Плотность (н. у.) = 0,808 г/см3 (-195,8°C);
- Молярный объем = 17,3 см3/моль.
Соединения азота:
- Аммиак
- Оксиды азота
- Азотная кислота
- Уравнения окислительно-восстановительных реакций азота…
Однозначано назвать ученого, который первым открыл азот не представляется возможным по той простой причине, что это практически одновременно сделали в 1772 году сразу трое – Генри Кавендиш, Джозеф Пристли и Даниэль Резерфорд (еще к этому списку можно причислить и Карла Шееле). Однако, ни один из ученых в свое время так и не понял до конца своего открытия. Многие “пальму первенства” отдают шотландцу Даниэлю Резерфорду, поскольку он первым опубликовал магистерскую диссертацию, в которой описал основные свойства “испорченного воздуха”.
Собственно название “азот” было предложено в 1787 году А. Лавуазье.
Азот является четвертым самым распространенным химическим элементом Солнечной системы (после водорода, гелия и кислорода). Азот является одним из самых распространенных элементов на Земле:
- в земной атмосфере азота содержится 3,87·1018 кг – 75,6% (по массе) или 78,08% (по объему);
- в земной коре азота содержится (0,7—1,5)·1018 кг;
- в земной мантии азота содержится 1,3·1019 кг;
- в гидросфере азота содержится 2·1016 кг (7·1014 кг в виде соединений).
Азот играет важнейшую роль в жизнедеятельности организмов – он присутствует в белках, аминокислотах, аминах, нуклеиновых кислотах.
Природный азот состоит из двух стабильных изотопов 14N — 99,635% и 15N — 0,365%.
Азот в Периодической таблице химических элементов Д. И. Менделеева, стоит под номером “7”, относится к 15(Va) группе (См. Атомы 15(Va) группы).
Атом азота содержит 7 электронов, которые располагаются на двух орбиталях (s и p) (см. Электронная структура атомов). На внутренней орбитали расположены 2 электрона; на внешней – 5 (одна свободная электронная пара + три неспаренных электрона, которые могут образовывать три ковалентные связи; см. Ковалентная связь).
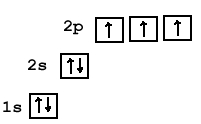
Вступая в реакции с другими химическими элементами, атом азота может проявлять степень окисления от +5 до -3 (кроме трех валентных электронов еще одна связь может образовываться по донорно-акцепторному механизму за счет свободной электронной пары с атомом, имеющим свободную орбиталь).
Степени окисления азота:
- +5 – HNO3;
- +4 – NO2;
- +3 – HNO2;
- +2 – NO;
- +1 – N2O;
- -1 – NH2OH;
- -2 – N2H4;
- -3 (самая распространенная) – NH3.
N2
Три неспаренных р-электрона атома азота, лежащие на его внешнем энергетическом уровне, имеют форму равноплечей восьмерки, располагаясь перпендикулярно друг к другу:
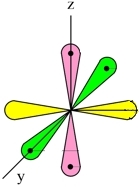
При образовании молекулы азота (N2) p-орбиталь, расположенная по оси X, одного атома, перекрывается с аналогичной px-орбиталью другого атома – в месте пересечения орбиталей образуется повышенная электронная плотность с формирование ковалентной связи (σ-связь).
Две другие орбитали одного атома, расположенные по осям Y и Z, перекрываются боковыми поверхностями со своими “собратьями” другого атома, образуя еще две ковалентные связи (π-связи).
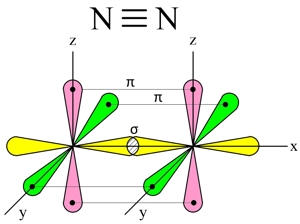
В итоге, в молекуле азота (N2) образуются 3 ковалентные связи (две π-связи + одна σ-связь), т. е., возникает очень прочная тройная связь (см. Множественные связи).
Молекула азота очень прочная (энергия диссоциации 940 кДж/моль), обладает низкой реакционной способностью.
Свойства молекулярного азота
В нормальных условиях азот является малоактивным веществом, что объясняется достаточно прочными межатомарными связями в его молекуле, поскольку образованы они аж тремя парами электронов. По этой причине, обычно азот вступает в реакции при высоких температурах.
Азот:
- газ без запаха и цвета;
- плохо растворим в воде;
- растворим в органических растворителях;
- может реагировать с металлами и неметаллами при нагревании в присутствии катализатора (под воздействием ионизирующего облучения);
- азот вступает в реакции как окислитель (исключение составляют кислород и фтор):
- при нормальных условиях азот реагирует только с литием:
6Li + N2 = 2Li3N; - при нагревании азот реагирует с металлами:
2Al + N2 = 2AlN; - при температуре 500°C и при высоком давлении в присутствии железа азот реагирует с водородом:
N2 + 3H2 ↔ 2NH3; - при температуре 1000°C азот реагирует с кислородом, бором, кремнием:
N2 + O2 ↔ 2NO.
- при нормальных условиях азот реагирует только с литием:
- азот взаимодействует, как восстановитель:
- с кислородом:
N20+O20 ↔ 2N+2O-2 (оксид азота II) - с фтором:
N20+3F20 = 2N+3F3-1 (фторид азота III)
- с кислородом:
Получение и применение азота
Получение азота:
- промышленным способом азот получают сжижением воздуха с последующим отделением азота путем испарения;
- лабораторные способы получения азота:
- разложением нитрита аммония:
NH4NO2 = N2 + 2H2O; - восстановлением азотной кислоты активными металлами:
36HNO3 + 10Fe = 10Fe(NO3)3 + 3N2 + 18H2O; - разложением азидов металлов (чистый азот):
2NaN3 → (t) 2Na + 3N2; - атмосферный азот получают реагированием воздуха с раскаленным коксом:
O2 + 4N2 + 2C → 2CO + 4N2; - пропусканием аммиака над оксидом меди (II) при t=700°C:
2NH3 + 3CuO → N2 + 3H2O + 3Cu.
- разложением нитрита аммония:
Применение азота:
- создание инертных сред в металлургии;
- синтез аммиака и азотной кислоты;
- производство взрывчатых веществ;
- для создания низких температур;
- производство минеральных удобрений: калийная селитра (KNO3); натриевая селитра (NaNO3); аммонийная селитра (NH4NO3); известковая селитра (Ca(NO3)2).
Источник

Азот – первый представитель главной подгруппы пятой группы, представитель пниктогенов. Именно поэтому эти элементы называют подгруппой азота. Однако азот имеет ряд особенностей:
Число ковалентных связей, образуемых атомом азота по обменному механизму, не может быть больше 3-х, так как у атома азота на внешнем электронном слое отсутствует d-орбиталь.
Электронная конфигурация атома азота:Атом азота может образовывать ковалентную связь по донорно-акцепторному механизму за счет наличия неподеленной электронной пары на 2s-подуровне. Подробнее эта тема раскрыта в разделе “Валентные возможности азота”

Высшая валентность N равна IV.
3. В соединениях с кислородом азот проявляет степени окисления: +1; +2; +3; +4; +5.
Степени окисления азота в его соединениях
аммиак летучее водородное соединение | свободный азот | низшие оксиды, несолеобразующие | + неустойчивый кислотный оксид | кислотный оксид | → + неустойчивый кислотный оксид | |
| В воздухе | азотистая кислота | азотная кислота | ||||
соли аммония нитриды | х нитриты | х нитраты | ||||
История открытия азота
Соединения азота – селитра, азотная кислота, аммиак – были известны задолго до получения азота в свободном состоянии.

В 1772 г. Д.Резерфорд, сжигая фосфор и другие в-ва в стеклянном колоколе, показал, что остающийся газ не поддерживает дыхания и горения. Д.Резерфорд назвал его «удушливым воздухом».
 К.Шееле назвал этот элемент, извлеченный из воздуха, «дурным воздухом».
К.Шееле назвал этот элемент, извлеченный из воздуха, «дурным воздухом».
В 1787 г. А.Лавуазье установил, что «жизненный» и «удушливый» газы, входящие в состав воздуха, это простые вещества, и предложил название «азот». «А» – отсутствие, «зоо» – жизнь. «Безжизненный» – азот.
И не случайно: испытания проводили на лабораторных мышах, помещая их под колпак с азотом, где они погибали.


ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Входит в состав воздуха: = 78%. Также входит в состав других неорганических соединений и состав живой материи.
Азот
немного легче воздуха; плотность 1,2506 кгм (при н.у.),
пл = – 209,8 , кип = -195,8
азот сжижается с трудом: плотность жидкого азота 800 кгм.
Жидкий азот используют для охлаждения различного оборудования и техники; для охлаждения компонентов компьютера при экстремальном разгоне. В химии жидкий азот применяют при работе с вакуумными линиями, для охлаждения веществ и проведения реакций при низких температурах, для создания инертной атмосферы. При этом транспортировка азота осуществляется в сосудах Дьюара:


В воде азот менее растворим чем кислород: при 0 в 1м растворяется 23,3 г азота.
Азот не поддерживает дыхание и горение; он чрезвычайно инертен. Малая реакционная способность азота обусловлена строением его молекулы.

N≡N — это самая прочная (из всех двухатомных) молекула. Молекула азота очень устойчива: энергия диссоциации ее на атомы составляет 942,9 кДж/моль, поэтому даже при температуре 3300 С степень диссоциации азота составляет 0,1%.
Азот – один из распространенных элементов на Земле.

– в атмосфере – 4 тонн по массе и 78% газообразного азота по объёму;
– литосфере – 1,9% по массе;
– в живых организмах – 0,3% по массе.
В белке животных и человека – 16–17% азота. В организмах человека и плотоядных животных белок образуется за счёт потребляемых белковых веществ травоядных животных и в растениях. “Жизнь – есть способ существования белковых тел на Земле” – по определению Ф.Энгельса.
СПОСОБЫ ПОЛУЧЕНИЯ АЗОТА
Промышленные способы:
Ректификация (разделение) жидкого воздуха:
сначала улетучивается
(t
кип
= -196
);
Лабораторные способы:
Окислительно-восстановительное разложение некоторых солей аммония:
= +
= + +
Окисление аммиака и солей аммония:
+ = +
+ = +
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
Молекулярный азот — химически инертное вещество (см.выше строение азота), поэтому легко реагирует только с металлами:
комн
Магний горит с образованием не только оксида, но и нитрида магния:
Азот при взаимодействии с металлами проявляет окислительные свойства: образуются нитриды металлов, в которых степень окисления азота равна -3.
С неметаллами азот реагирует тяжелее: для инициирования и ускорения реакций необходимо применять высокие температуры, искровые электрические разряды, ионизирующее излучение, катализаторы (Fe, Cr, V, Ti и их соединения):
катР
элразряд
+
Реакция горения азота идет при высокой температуре, в электрическом разряде или в присутствии катализатора:
Обратите внимание: реакция эндотермическая!
Азот не реагирует со сложными веществами.
Источник
