В каких условиях интенсивнее образование нитрозосоединений в продуктах
Нитрозосоединения (пояснения в тексте)
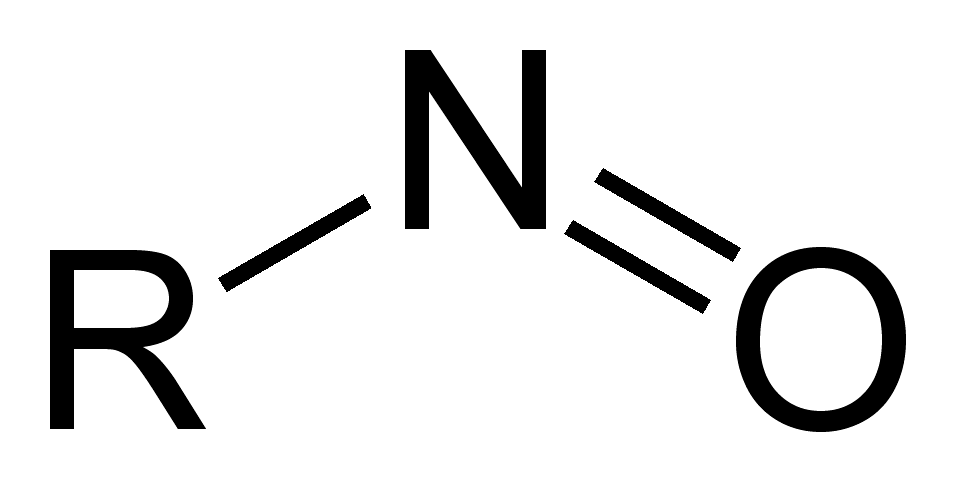
Нитрозосоединения — органические, содержащие одну или несколько нитрозогрупп —N=O, связанных с атомами углерода (C-нитрозосоединения), азота (N-нитрозосоединения — нитрозамины, R2N-N=O) или кислорода (O-нитрозосоединения — органические нитриты, сложные эфиры азотистой кислоты) [1], серы (нитрозотиолы, RS-N=O) [2]. Под нитрозосоединениями обычно подразумевают C-нитрозосоединения. Можно рассматривать эти соединения, как углеводородные производные нитрозила. Известны и неорганические нитрозильные соединения, как с металлами (M-N=O) так и с неметаллами (например, Cl-N=O, NO-ClO4) [2].
Свойства[править | править код]
Нитрозосоединения способны к димеризации и в растворах и расплавах существуют в виде равновесных смесей мономера и димера, в индивидуальном состоянии большинство нитрозосоединений представляют собой димеры, для которых возможна цис–транс-изомерия[3]:
При введении электроноакцепторных заместителей тенденция к димеризации уменьшается: трихлор- и трифторнитрозометаны существуют преимущественно в виде мономеров. Транс-изомеры стабильнее цис-изомеров. В растворах и при нагревании увеличивается степень диссоциации димеров.
Органические нитрозосоединения способны к координационным взаимодействиям с ионами металлов [2].
Мономерные нитрозосоединения окрашены в зелёный или голубой цвет, в спектрах мономерных нитрозосоединений наблюдаются три максимума: в видимой области при 630—790 нм (e ~ 45-60, полоса nπ-перехода), в ультрафиолетовой области — при 270—290 нм (e ~ 80, полоса σπ*-перехода) и 220 нм (e ~ 5⋅103, полоса ππ*-перехода). Димерные нитрозосоединения бесцветны в УФ-спектрах транс-изомеров полоса поглощения при 280—300 нм (e ~ 5⋅103 — 12⋅103, полоса ππ*-перехода), у цис-изомеров эта полоса сдвинута в коротковолновую область на 10-15 нм[3].
В ИК-спектрах мономерных нитрозосоединений присутствует характеристическая полоса при 1540—1620 см−1 (алифатические нитрозосоединения) или 1500—1512 см−1 (ароматические нитрозосоединения) валентных колебаний нитрозогруппы. У транс-димеров алифатических и ароматических нитрозосоединений эта полоса наблюдается при 1176—1290 и 1253—1299 см−1 соответственно, у цис-димеров эти полосы проявляются в виде дублетов при 1323—1344 см−1 и 1330—1420 см−1 (у алифатических нитрозосоединений) и 1389 см−1 и 1409 см−1 (у ароматических нитрозосоединений)[3].
В масс-спектрах (в том числе для димеров) присутствуют пики молекулярных ионов и пики характеристической фрагментации. Общей чертой является лёгкость отщепления NO[3].
Реакционная способность[править | править код]
Проявляют слабые основные свойства.
Особенностью первичных и вторичных нитрозосоединений (то есть содержащих атом водорода в α-положении к нитрозогруппе), является способность к необратимой изомеризации в оксимы[3]:
Такая изомеризация проходит in situ при нитрозирования некоторых алканов (например, циклогексана нитрозилхлоридом NOCl) или соединений с активированной метильной либо метиленовой группой и служит препаративным методом синтеза оксимов:
Повышение температуры, полярные растворители, сильные кислоты или основания, а также NO ускоряют изомеризацию (в последнем случае конкурентным процессом является димеризация с образованием алкилацилгидразинов).
Оксимы могут образовываться и в результате фрагментации некоторых третичных нитрозосоединений[3]:
Для соединений с нитрозогруппой вообще характерна таутомерия: если помимо нитрозогруппы соединение содержит ещё какие-либо группы с высоко электроотрицательным атомом, то таутомерные перегруппировки будут вести к образованию не только оксимов, но и других классов соединений. Например, п-нитрозофенол существует в равновесии с оксимом п-бензохинона (последний преобладает); о-нитрозофенол мало склонен к таутомерии; п-нитрозоанилины также существуют в равновесии со своими хиноидными изомерами.
Возможны и другие варианты внутримолекулярных взаимодействий: водородные связи, изомеризация о-динитрозобензолов в бензофуроксаны.
Реакции окисления[править | править код]
Окислители (например: озон, пероксид водорода в щелочной среде, надкислоты, кислород воздуха, азотная кислота, перманганат, оксид хрома (VI) и другие подобные по окислительной силе) легко окисляют нитрозогруппу до нитрогруппы. Алифатические нитрозосоединения окисляются несколько легче ароматических. В случае последних, окисление облегчается при наличии электронодонорных заместителей в пара-положении к нитрозогруппе.
Реакции восстановления[править | править код]
В зависимости от восстановителя, удаётся превратить нитрозосоединения в амины и, в случае более мягких восстановителей (например, спиртовые растворы щелочей, арсенит, борогидрид натрия), в гидроксиламины. Последние легко конденсируются с остающимися в смеси нитрозосоединениями до азоксисоединений. Для защиты нитрозогруппы от дальнейшего восстановления и конденсации используют ароматические сульфиновые кислоты. Для получения аминов используют более интенсивные восстановители: дитионит натрия, гидрирования с катализаторами (например, с никелем Рения или условия металл-кислота). Биснитрозоалканы могут восстанавливаться сразу в амино-, азокси- и гидразосоединения, не переходя в мономеры. При восстановлении гем-нитрозохлорсоединений гидридами металлов образуются оксимы.
Известны реакции дезоксигенирования нитрозосоединений производными трёхвалентного фосфора (до азоксисоединений, до фосфоимидатов и продуктов их гидролиза, до ряда других продуктов), изоцианидами (до карбодиимидов).
Гем-нитрозохлорциклоалканы при десоксигенировании фосфином претерпевают перегруппировку Бекмана с расширением цикла. Реакцией нитрозофенола с трифенилфосфином в бензоле (в присутствии диалкиламинов) удалось синтезировать 2-амино-3-N-азепины.
Реакции с ненасыщенными системами[править | править код]
Реакции присоединения и конденсации[править | править код]
Реакции захвата радикалов[править | править код]
Нитрозосоединения (особенно ароматические) являются хорошими ловушками для захвата свободных радикалов. Их используют для ингибирования реакций полимеризации (протекающих по радикальному механизму). В общем случае реакция с радикалами приводит к образованию полностью замещённых гидроксиламинов (например, реакция нитрозометана с метильными радикалами приводит к образованию триметилгидроксиламина).
Также ароматические нитрозосоединения реагируют с NO, давая нитраты диазония или продукты их разложения. Алифатические нитрозосоединения в подобных реакциях дают нитросоединения, нитраты и следы нитритов.
Фотохимические реакции[править | править код]
При облучении нитрозосоединений обычно образуются нитроксилы. Для алифатических нитрозосоединений обычно требуется красный свет (>680 нм), для ароматических — обычно ультрафиолетовый. Гомологи нитрозобензола начинают реагировать при облучении более длинноволновым светом, чем сам нитрозобензол. Один из побочных процессов при облучении нитрозоаренов — восстановление их до азоксисоединений.
При облучении нитрозоалканов также наблюдается их димеризация, расщепление C-N и C-H связей, в присутствии кислорода — окисление.
Реакции замещения[править | править код]
В ароматических нитрозосоединениях, в силу того, что нитрозогруппа является сильным акцептором электронов (для сравнения — сильнее, чем нитрогруппа), под действием нуклеофильных реагентов достаточно легко протекают реакции обмена пара-заместителями.
Так, п-нитрозодиметиланилин гидролизуется водными растворами щелочей до оксима хинона и диметиланилина.
Электрофильное замещение также ведёт к образованию пара-продуктов (например, при бромировании или при нитровании).
Качественное и количественное определение[править | править код]
- Взаимодействие с азотистой кислотой с образованием N- нитрозаминов. Последние плохо растворимы в воде и выделяются в виде желтых кристаллов или масла.
- Реакция с фенолом или резорцином в концентрированной серной кислоте — появляется тёмно-красное окрашивание, после добавления NaOH переходящее в тёмно-голубое (реакция Либермана).
- Реакция со смесью серной кислоты и дифениламином — появляется интенсивное голубое окрашивание.
- Для количественного определения измеряют количество азота, выделяющегося в реакции с фенилгидразином
Нитрозосоединения применяют как полупродукты в синтезе аминокислот, гетероциклических соединений, некоторых других классов соединений. Они являются промежуточными продуктами при превращениях между нитро- и аминогруппами, что может быть существенно для планирования синтезов. Используются при переработке (и иногда как отвердители) эластомеров. Применяют их и как аналитические реагенты. Орто-нитрозофенолы и орто-нитрозонафтолы применяют для синтеза красителей (обычно не сами, а их анионные комплексы с d-металлами) и для синтеза лекарственных препаратов. Некоторые представители обладают канцерогенной и мутагенной активностью, могут вызывать кожные заболевания[4].
В организме нитрозосоединения (и нитроксильные радикалы) образуются как промежуточные продукты метаболизма нитритов и нитратов, вместе с аминами нитриты могут участвовать в спонтанных реакциях нитрозилирования (например, попадая из пищеварительного тракта в кровь, могут нитрозилировать гемоглобин и миоглобин). Показано, что такие реакции протекают интенсивнее в условиях высокой закисленности (например, в желудке), высокой концентрации аминов (например, белковая диета), низкой концентрации витамина С (реагирует с нитритами, превращая их NO)[2].
Методы получения[править | править код]
Из более восстановленных соединений[править | править код]
- Окисление аминов и гидроксиламинов
Обычно в качестве окислителей используют пероксикислоты (Например, монопироксисерную кислоту).
В случае окисления первичных ароматических аминов выходы составляют порядка 65%. Реакция идёт и с первичными алифатическими аминами (аминогруппа при третичном углеродном атоме), но с на порядок меньшими выходами. Алифатические амины, в которых аминогруппа связана с первичным или вторичным углеродным атомом в основном превращаются в первичные либо вторичные биснитрозосоединения, либо в оксимы [3][5].
С высокими выходами алифатические биснитрозосоединения получают в реакциях:
- Окисление пероксикислотами нитронов и азометинов
- Окисление N-замещённых гидроксиламинов различными окислителями. Для алифатических соединений подходят: водные растворы галогенов, Оксид ртути(II), хромовая кислота, йодная кислота, карбонат серебра в дихлорметане. Для ароматических производных применяют: перманганат в кислой среде, хлорид железа(III), тетраацетат свинца. Для особенно чувствительных к окислению соединений подходят диэтиловый эфир азодикарбоновой кислоты.
Вообще, некоторые алкилгидроксиламины склонны самопроизвольно диспропорционировать на амин и нитрозосоединение. Способ хорошо подходит для получения третичных нитрозосоединений [3].
Из более окисленных соединений[править | править код]
- Восстановление нитросоединений возможно, но неудобно использовать как метод получения нитрозосоединений – так как обычно трудно остановить восстановление на нужной стадии. Можно получить гем-нитрозохлорсоединения обработкой солей нитросоединений эфирным раствором хлороводорода:
Для аккуратного восстановления нитросоединений необходимо использовать слабые восстановители, в нейтральных растворах. Например, применяют гидроксиламин, сульфид натрия, оксид олова(II) в метанольных растворах щелочей [3].
Реакции нитрозирования[править | править код]
- Реакции нитрозирования подобны реакциям нитрования. Ароматические соединения, содержащие при бензольном кольце электронодонорные заместители (OH, NR2, NHR) при взаимодействии с водными разбавленной азотистой кислотой (можно использовать в качестве источника азотистой кислоты подкисленные растворы нитритов щелочных металлов), переходят в нитрозосоединения (нитрозогруппа замещает атом водорода преимущественно в пара-положении к имевшемуся заместителю). Нитрозирующими агентами могут быть катион нитрозония NO+, оксиды N2O3 и N2O4, молекулы азотистой кислоты.
Реакции ведут при низких (порядка 273 K) температурах (при повышении температуры уменьшается выход продукта)[6].
- O-Нитрозосоединения могут быть получены в реакции этерификации спиртов с азотистой кислотой:
- S-нитрозосоединения могут быть получены тем же путём (эти реакции протекают интенсивнее, чем в случае спиртов, так как атом серы является более нуклеофильным):
Соединения стабильны в кислых растворах.
- Пример реакции получения нитрозаминов за счёт генерации иона нитрозония NO+ из нитрит-иона NO2-:
Таким образом, например, при консервировании мяса могут образовываться (в том числе и канцерогенные) нитрозосоединения из аминов (нитриты часто используются как консерванты и фиксаторы окраски).
Первичные нитрозамины подвержены гидролизу до спиртов, более устойчивы вторичные и ароматические нитрозамины[2].
Прочие реакции[править | править код]
- Синтезы из алкилнитрилов
- Свободнорадикальные процессы
- Присоединение к алкенам
- Галогенирование оксимов
- Фотохимические реакции алканов (в газовой фазе) с оксидом азота (II) в присутствии каталитических количеств хлора приводит к образованию биснитрозоалканов:
При увеличении доли хлора в смеси получаются гем-нитрозохлорсоединения, которые могут быть далее восстановительно дегалогенированы до оксимов:
При облучении смеси алкана и с хлороводородом в присутствии NO также получаются оксимы. В условиях избытка (3:1) NO получают биснитрозосоединения.
Получение методами фотолиза обычно ведёт к смеси изомеров [3].
Литература[править | править код]
- Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3 «Азотсодержащие соединения»
- Биляев Е.У, Гидаспов Е. В. «Ароматические нитрозосоединения» С-Пб.:Теза, 1996. — 208 с.
- Губен И. «Методы органической химии» том 4, книга 1. М.:ГХИ, 1949. — С.: 98-191
- Фойер Г. (ред.) «Химия нитро- и нитрозосоединений» в 2 т., М.:Мир, 1972.
- Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3
- Lijinsky W. «Chemistry and biology of N-nitroso compaunds». 1992. N.Y.
- Patai S., Rappoport Z. «Amino, Nitroso, Nitro and Related Groups» («The Chemistry of Functional Groups»). 1996. John Wiley & Sons Ltd. — 1423 p.
Примечания[править | править код]
- ↑ nitroso compounds // IUPAC Gold Book
- ↑ 1 2 3 4 5 перевод англоязычной версии статьи
- ↑ 1 2 3 4 5 6 7 8 9 10 Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3, стр. 372—399
- ↑ Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3, С.: 271—275
- ↑ Губен И. “Методы органической химии” том 4, книга 1. М.:ГХИ, 1949. – С.: 98-191
- ↑ Лисицын В. Н. «Химия и технология промежуточных продуктов» — М.:Химия, 1987. — 368 с. — С.: 134—138
Источник
16.01.2016, 14:19
В.Г. Беспалов
НИИ онкологии им. Н.Н. Петрова Минздрава России, Санкт-Петербург, Россия
Канцерогенные нитрозосоединения могут поступать в продукты из загрязненной окружающей среды, в небольших количествах они содержатся в копченом, вяленом, консервированном мясе и рыбе, темных сортах пива, сухой и соленой рыбе, маринованных и соленых овощах. Однако главным является загрязнение пищи предшественниками нитрозосоединений: нитратами и нитритами. В результате современных агрохимических мероприятий, использования минеральных удобрений, овощи и другие растительные продукты содержат довольно много нитратов. Сами по себе нитраты безопасны. Опасность заключается в том, что около 5% нитратов восстанавливается в пище или в организме до нитритов,
Наибольшее количество нитратов содержат овощи, выращиваемые на повышенных количествах азотистых удобрений: салат, шпинат, сельдерей, ревень, редис, редька, свекла, баклажаны, картофель. Конечно, если эти овощи выращены на естественных удобрениях, то нитратов в них нет. Нитраты прекрасно переходят в воду при варке овощей. Затем, если сваренный суп или борщ стоит при комнатной температуре, то в нем быстро образуются нитриты. Морковь, свекла, картофель и другие овощи долго могут лежать при комнатной температуре и кажутся свежими, однако содержащиеся в них нитраты при этой температуре быстро превращаются в нитриты. Уже при температуре + 2°С невозможно превращение нитратов в нитриты. Именно такая температура поддерживается в камерах современных холодильников. Сейчас у каждой семьи имеются холодильники. Между тем, многие хозяйки не считают нужным быстро охладить приготовленную еду и спрятать ее в холодильник, не хранят овощи и фрукты в холодильнике, а это необходимо делать. Хорошо деревенским жителям, они могут хранить овощи в погребах и в ледниках, где поддерживается достаточно низкая температура. Городскому жителю можно лишь посоветовать не покупать овощи и фрукты, в том числе второй хлеб – картофель – в количествах, превышающих возможности его холодильника.
Нитриты очень токсичны. Высокое содержание нитритов выявляется в мясных копченостях, мясных консервах и колбасных изделиях. Это связано с применением в технологии производства этих продуктов солей азотистой кислоты. Частый путь поступления нитритов в организм – в виде пищевых добавок. Нитриты являются прекрасными консервантами и с прошлого века используются для сохранения мясных продуктов. И хотя сегодня хорошо известно об их онкологической опасности, добавки нитритов, чаще всего нитрита натрия, широко применяют при приготовлении колбас, ветчин, бекона, мясных консервов. Перечисленные продукты, содержащие нитриты, не должны быть в повседневном питании.
Однако нитраты и нитриты не только вредны, но и обладают полезными свойствами. Недавно выявлено, что из нитратов в организме образуется монооксид азота, который расширяет сосуды и снижает риск сердечно-сосудистых заболеваний, инфаркта миокарда и инсульта, а также улучшает потенцию у мужчин по типу знаменитого лекарственного препарата виагры. Нитраты также благоприятно влияют на здоровье пациентов с болезнями почек и язвой желудка, ослабляют проявления метаболического синдрома. Причем именно выращенные на азотистых удобрениях загрязненные овощи и фрукты содержат достаточную дозу нитратов для проявления этих полезных свойств. Поэтому когда мы не можем регулярно употреблять органические овощи и фрукты и стоим перед выбором, есть ли нам загрязненные овощи и фрукты из наших магазинов или вообще отказаться от их употребления, лучше все-таки есть загрязненные овощи и фрукты, а не лишать себя необходимой для здоровья растительной пищи.
Читать все статьи
Читать все статьи
Рисунок. Общая формула нитрозосоединений
которые, в свою очередь, являются предшественниками канцерогенных нитрозосоединений. Другие предшественники нитрозосоединений – амины и амиды – обнаружены в разнообразных пищевых продуктах. В результате нитрозирования нитритами аминов и амидов возникают канцерогенные нитрозосоединения (нитрозамины и нитрозамиды). Синтез канцерогенных нитрозосоединений из предшественников самопроизвольно идет в продуктах при комнатной температуре. Обработка продуктов коптильным дымом, обжаривание, консервирование и засолка резко ускоряют образование в них канцерогенных нитрозосоединений. В противоположность этому, хранение продуктов при низких температурах в холодильниках резко тормозит их образование. Синтез канцерогенных нитрозаминов и нитрозамидов из пищевых предшественников происходит и в самом организме: желудке, кишечнике и мочевом пузыре. В исследовании добровольцам давали овощной сок с высоким содержанием нитратов, после чего у них в моче обнаруживали большое количество нитрозосоединений. Канцерогенные нитрозосоединения могут вызывать у человека опухоли желудка, пищевода, печени, носовой полости, глотки, почек, мочевого пузыря, головного мозга и других органов.
Источник
