В какой массе naoh содержится
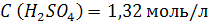
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РH3, H2О, НВr. Решение
2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН. Решение с ключом
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Решение с ключом
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Решение с ключом
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. Решение с ключом
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Решение
7. Выразите в молях: а) 6,02·1022 молекул C2H2; б) 1,80·1024 атомов азота; в) 3,01·1023 молекул NH3. Какова мольная масса указанных веществ? Решение
8. Вычислите эквивалент и эквивалентную массу H3PO4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата. Решение
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла? Решение с ключом
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла. Решение с ключом
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида, вычислите эквивалентную массу этого металла. Решение
12. Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций. Решение с ключом
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы. Решение
14. В каком количестве Сr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Решение
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их эквиваленты и эквивалентные массы. Решение с ключом
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла? Решение с ключом
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла. Решение с ключом
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Решение с ключом
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Решение с ключом
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании, расчета напишите уравнение реакции. Решение
Источник
Примеры решения задач
1.1. ПРОЦЕНТНАЯ КОНЦЕНТРАЦИЯ
Пример 1
а) Определите массовую долю (%) хлорида калия в растворе, содержащем 0,053 кг KCl в 0,5 л раствора, плотность которого 1063 кг/м3.
Решение:
Массовая доля ω или С% показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:
где ωA – массовая доля (%) растворенного вещества;
mA- масса растворенного вещества, г;
mр-ра – масса раствора, г.
Масса раствора равна произведению объема раствора V на его плотность ρ:
m=ρV, тогда
Массовая доля хлорида калия в растворе равна:
Пример 2
Какой объем раствора азотной кислоты с массовой долей HNO3 30% (ρ=1180кг/м3) требуется для приготовления 20 л 0,5 М раствора этой кислоты?
Решение: Сначала определяем массу азотной кислоты в 20 л 0,5 М раствора:
M (HNO3)=63,01 г/моль;
mHNO3=0,5∙63,01∙20=630,1 г.
Определим, в каком объеме раствора с массовой долей HNO3 30% содержится 630,1 г HNO3 :
Следовательно , чтобы приготовить 20 л 0,5 М HNO3, надо израсходовать всего 1,78 л раствора азотной кислоты с массовой долей HNO3 равной 30%.
Пример 3
Какую массу раствора с массовой долей КОН 20% надо прибавить к 250 г раствора с массовой долей КОН 90%, чтобы получить раствор с ωКОН=50 %?
Решение: Задача решается с помощью правила смешения. Массу раствора с массовой долей КОН 20 % обозначим через х.
Тогда 3х=1000; х=333,3.
Для получения раствора с массовой долей КОН 50 % необходимо к 250 г раствора КОН с ω=90 % прибавить 333,3 г раствора КОН с 20 %.
Задачи такого типа решают с помощью диагональной схемы или «правила креста»: точкой пересечения двух отрезков прямой обозначают свойства смеси, которую необходимо получить.
20 (90-50)=40
50
90 (50-20)=30
Массы исходных растворов, необходимые для приготовления смеси, обратно пропорциональны разностям между концентрациями заданного и менее концентрированного раствора и более концентрированного и заданного растворов:
Также эту задачу можно решить, учитывая, что при сливании двух растворов суммируется масса растворенного вещества. Пусть масса 20% раствора х г, тогда масса КОН в нем 0,2 х. Масса КОН во втором растворе 0,9 · 250 = 225 г. Масса вещества в итоговом растворе 0,5 · (250 + х). Таким образом,
0,2х + 225 = 0,5(250+х); х=333,3 г.
1.2. МОЛЯРНАЯ И ЭКВИВАЛЕНТНАЯ КОНЦЕНТРАЦИИ
Пример 1
Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение:
Молярная концентрация См или М (молярность) показывает количество растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию (моль/л) выражают формулой
где m1 – масса растворенного вещества, г;
M – молярная масса растворенного вещества, г/моль;
V – объем раствора, л.
M (NaOН)=40 г/моль. Масса NaOH, содержащегося в растворе, равна
MNaOH=MV=0,2∙40∙0,2=1,6 г.
Пример 2
Определите молярную концентрацию эквивалента хлорида железа (ІІІ), если в 0,3 л раствора содержится 32,44 г FeCl3.
Решение:
Молярная концентрация эквивалента вещества (нормальность) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1л раствора (моль/л):
где mА – масса растворенного вещества, г;
M (1/zА) – молярная масса эквивалента растворенного вещества, г/моль;
V – объем раствора, л.
Молярная масса эквивалента FeCl3 равна
Молярная концентрация эквивалента раствора FeCl3 равна
Пример 3
Определите концентрацию раствора КОН, если на нейтрализацию 0,035 л 0,3 н. H3PO4 израсходовано 0,02 л раствора КОН.
Решение:
Из закона эквивалентов следует, что количество эквивалентов веществ участвующих в химической реакции одинаково. В реакции участвуют 0,035·0,3=0,0105 эквивалента фосфорной кислоты. Для нейтрализации H3PO4
потребуется такое же количество вещества эквивалента КОН, т.е.
V(H3PO4)СН(H3PO4)=V(KOH)СН(KOH).
Отсюда
1.3. МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ (МОЛЯЛЬНОСТЬ) , МОЛЬНАЯ ДОЛЯ, ТИТР
Пример 1
В какой массе эфира надо растворить 3,04 г анилина C6H5NH2 , чтобы получить раствор, моляльность которого равна 0,3 моль/кг?
Решение:
Моляльность раствора Сm (моль/кг) показывает количество растворенного вещества, находящегося в 1 кг растворителя:
где mр-ля – масса растворителя, кг;
n (А) – количество растворенного вещества, моль.
M (C6H5NH2 ) – 99,13 г/моль.
Масса растворителя (эфира) равна:
тогда
Пример 2
Определите титр 0,01 н. КОН.
Решение:
Титр раствора показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л 0,01 н. КОН содержится 0,564 г КОН. Титр этого раствора равен:
Т= 0,561/1000=0,000561 г/мл.
Пример 3
Рассчитайте молярные доли глюкозы C6H12O6 и воды в растворе с массовой долей глюкозы 36 %.
Решение:
Мольная доля вещества А(χА) в растворе равна отношению количества данного вещества nА к общему количеству всех веществ, содержащихся в растворе:
где ( ) количество всех веществ, содержащихся в растворе.
В 100 г раствора с массовой долей глюкозы, равной 36 %, содержится 36 г глюкозы и 64 г воды:
nC6H12O6 =36/180=0,20 моль;
nH2O= 64/18= 3,56 моль;
nC6H12O6 + nH2O= 0,20 + 3,56 =3,76 моль;
χC6H12O6= 0,20/3,76= 0,053;
χH2O= 3,56/3,76= 0,947.
Сумма молярных долей всех компонентов раствора равна 1.
Пример 4
Вычислите молярную концентрацию эквивалента, молярную концентрацию и моляльность раствора, в котором массовая доля CuSO4 равна 10 %. Плотность раствора 1107 кг/м3.
Решение:
Определим молярную массу и молярную массу эквивалента CuSO4:
M (CuSO4)= 159,61 г/моль; M(1/2 CuSO4)=
В 100 г раствора с ωCuSO4=10 % содержится 10,0 г CuSO4 и 90 г H2O.
Следовательно, моляльность раствора CuSO4 равна
Сm(CuSO4/H2O)=10/(159,61∙0,09)=0,696 моль/кг.
Молярная концентрация и молярная концентрация эквивалента относятся к 1л раствора:
mр-ра= ρV= 1107·10-3=1,107 кг.
В этой массе раствора содержится 1,107·0,1=0,1107 кг CuSO4, что составляет 110,7/159,61=0,693 моль, или 0,693·2=1,386 экв.
Молярная концентрация и молярная концентрация эквивалента данного раствора соответственно равны 0,693 и 1,386 моль/л.
1.4. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН ВАНТ- ГОФФА
Пример 1
Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в
1,4 л 63 г глюкозы С6Н12О6 при 0°С.
Решение:
Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
Pocм = nRT/V,
где п — количество растворенного вещества, моль;
V – объем раствора, м3;
R — молярная газовая постоянная, равная 8,3144 Дж/(моль-К).
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180,16 г/моль. Следовательно, в 1,4л раствора содержится
n= 63/180,16=0,35моль глюкозы.
Осмотическое давление этого раствора глюкозы:
Пример 2
Определение молекулярной массы неэлектролита по осмотическому давлению раствора.
Рассчитайте молекулярную массу неэлектролита, если в 5л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 0,23∙105 Па при 20°С.
Решение:
Заменив п выражением m/M, где т — масса растворенного вещества, а М — его молярная масса, получим
Росм = mRT/(MV).
Отсюда молярная масса растворенного вещества равна
Следовательно, молекулярная масса неэлектролита равна 52,96
Росм кПа: R=8,31 Дж/моль∙К;
Росм мм Hg ст.: R=62,32 л∙мм.рт.ст./град.∙моль;
Росм. атм.: R=0,082 л∙атм../град.∙моль.
1.5.ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА РАСТВОРОВ. ТОНОМЕТРИЧЕСКИЙ ЗАКОН РАУЛЯ
Пример 1. а) Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при этой температуре равно 2,5·104 Па.
Решение:
Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
где p0 – давление пара над чистым растворителем;
p – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль;
M (C12H22O11) = 342,30 г/моль;
M (H2O) = 18,02 г/моль.
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
Пример 2. Рассчитайте молекулярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40°С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение:
Относительное понижение давления пара растворителя над раствором равно
Находим:
здесь mx – масса неэлектролита, молярная масса которого Mx г/моль.
0,309Mx + 0,202=28,5;
0,309Mx =28,298;
Mx=91,58 г/моль.
Молекулярная масса неэлектролита равна ~ 92.
1.6. ТЕМПЕРАТУРЫ КИПЕНИЯ И ЗАМЕРЗАНИЯ РАСТВОРОВ.
ЭБУЛЛИОСКОПИЧЕСКИЙ И КРИОСКОПИЧЕСКИЙ ЗАКОНЫ РАУЛЯ
Пример 1.Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,1 °С. Температура кипения чистого бензола 80,2 °С, температура замерзания –5,4°С.
Решение:
По закону Рауля:
где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Кк и Кэ – соответственно криоскопическая и эбуллиоскопическая константы растворителя; g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:
Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
Температура замерзания раствора tзам= 5,4 – 4,14 =1,26 °C.
Пример 2.Раствор камфоры массой 0,522 г в 17 г эфира кипит при температуре на 0,461ºС выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16 ºС. Определите молекулярную массу камфоры.
Решение:
Молекулярную массу камфоры определяем, пользуясь соотношением
Mr=
Молекулярная масса камфоры равна 155,14.
Читайте также:
Рекомендуемые страницы:
©2015-2020 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2016-07-22
Нарушение авторских прав и Нарушение персональных данных
Источник
Концентрация
раствора –
величина, измеряемая количеством
растворенного вещества, содержащегося
в определенной массе или объеме
растворителя.
Ниже
приведены наиболее часто употребляемые
в химии способы выражения содержания
растворенного вещества в растворе:
Таблица
1.
Способ | Определение | Формулы, | Единицы |
массовая ω | процентное | m(X) ω= ————– • 100% m(р-ра) | % доли |
мольная N | отношение | n1 N1 (n1 ni Ni ∑ ni | _ |
молярная С(X); | отношение | n(x) С(Х)=———- = V(р-ра) m(x) = M(X)•V(р-ра) 10 C(x) M(X) | моль./л |
эквивалентная С(1/z CN | отношение | n(1/zX) CN= ————- = V(р-ра) m(X) = M(X) 10 С(1/zX) = ————— М(1/z C(1/z | моль/л |
моляльная b(X) | отношение | n(X) b(X)= ———- = m(р-ля) m(X) = М(X) | моль/кг |
Условные обозначения:
m(X)
– масса растворенного вещества;
M(X)
– молярная масса растворенного вещества;
V(р-ра)
– объем раствора;
m(р-ля)
– масса растворителя;
n1иn2 – соответственно
количество вещества растворителя и
растворенного вещества;
n(1/z)
– количество эквивалентов растворенного
вещества;
n(X)
– количество растворенного вещества.
§4. Задачи для самостоятельного решения.
1.
Рассчитайте молярную массу эквивалента
карбоната натрия, бикарбоната натрия,
тетрабората натрия, карбоната кальция,
оксалата калия, иодата калия, янтарной
кислота, бензойной кислоты.
2.
Рассчитайте молярную массу эквивалента
ортофосфорной кислоты H3PO4
в реакциях с гидроксидом натрия с
образованием NaH2PO4,
Na2HPO4,
Na3PO4.
3.
Рассчитайте молярную массу эквивалента
H2S
в реакциях с гидроксидом натрия с
образованием NaHS
и Na2S.
4.
Какой объем раствора НС1 (в мл) с молярной
концентрацией С1(НС1)=10,97
моль/л необходимо взять для получения
100 мл раствора с молярной концентрацией
С2(НС1)=0,1
моль/л?
5.
Какая навеска безводного карбоната
натрия Na2CO3
требуется для приготовления 100 мл
раствора с молярной концентрацией
эквивалента С(½ Na2CO3)=0,1
моль/л?
6.
Определите массу Na2CO3
• 10 Н2О
(кристаллической соды), необходимую для
приготовления 500 мл 0,5 N
раствора.
7.
Сколько миллилитров 38% раствора
хлороводородной кислоты (ρ=1,19 г/мл) нужно
взять для приготовления 500 мл 0,3N
раствора?
8.
Определите массу нитрата натрия и объем
воды, необходимые для приготовления:
а) 200 г 15% раствора; б) 50 г 8% раствора?
9.
Найдите массу CuSO4
• 5 H2O
и объем воды, необходимые для приготовления
200 г 8% раствора сульфата меди (II).
10.
К 150 г 8% раствора прибавили 50 г воды.
Какова массовая доля растворенного
вещества в новом растворе?
11.
Какая масса NaOH
содержится в 550 г воды 0,72 моляльного
раствора?
12.
Какова моляльная концентрация раствора,
полученного растворением 1,5 кг хлорида
калия в 2,85 кг воды?
13
Вычислите мольные доли спирта и воды в
96%-ом (по массе) растворе этилового
спирта.
Соседние файлы в предмете Химия
- #
- #
Источник
| Дано: | Решение: |
| V (р-ра) = 500 мл = 0,5 л m (NaOH) = 5 г | 1. Вычислим число моль (n) в 5 г NaOH: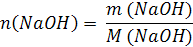 M (NaOH) = 40 г/моль 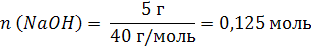 2. Определим молярную концентрацию раствора: 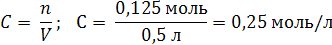 |
| Найти: C(NaOH) | |
| Ответ: Молярная концентрация раствора гидроксида натрия равна 0,25 моль/л. |
2. Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200 мл, если его молярная концентрация 2 моль/л.
| Дано: | Решение: |
| V (р-ра) = 200 мл = 0,2 л C (NaCl) = 2 моль/л | 1. Вычислим число моль NaCl, которое содержится в растворе объемом 0,2 л: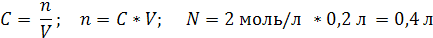 2. Вычислим массу NaCl: 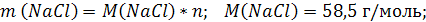 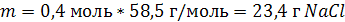 |
| Найти: m( NaCl) | |
| Ответ: m (NaCl) = 23,4 г. |
3. Вычислить молярную концентрацию раствора серной кислоты, если массовая доля H2SO4 в этом растворе 12%. Плотность раствора 1,08 г/мл при 200C.
| Дано: | Решение: |
| ρ (р-ра) = 1,08 г/мл ω (H2SO4) = 12% = 0,12 | 1. Чтобы перейти от массовой доли (%) растворенного вещества к молярной концентрации, надо рассчитать, какую массу имеют 1000 мл раствора: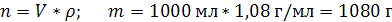 2. Вычислим массу серной кислоты в этом растворе: 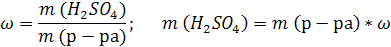 t wx:val=”Cambria Math”/><w:i/><w:sz w:val=”28″/><w:lang w:val=”RU”/></w:rPr><m:t>1080 Рі*0,12=129,6 Рі</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR=”00000000″><w:pgSz w:w=”12240″ w:h=”15840″/><w:pgMar w:top=”1134″ w:right=”850″ w:bottom=”1134″ w:left=”1701″ w:header=”720″ w:footer=”720″ w:gutter=”0″/><w:cols w:space=”720″/></w:sectPr></w:body></w:wordDocument>”>  3. Сколько молей содержится в 129,6 г H2SO4? 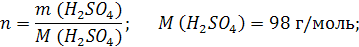 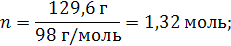 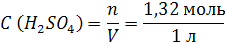 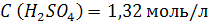 |
| Найти: C (H2SO4) | |
| Ответ: Молярная концентрация раствора серной кислоты с массовой долей H2SO4 12% равна 1,32 моль/л. |
4. Молярность раствора едкого кали KOH равна 3,8 моль/л, его плотность 1,17 г/мл. Вычислить массовую долю (%) KOH в этом растворе.
| Дано: | Решение: |
| C (KOH) = 3,8 моль/л ρ (р-ра) = 1,17 г/мл | 1. Определим количество вещества KOH в 1 л раствора: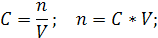 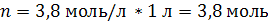 2. Определим массу KOH в 1 л раствора: 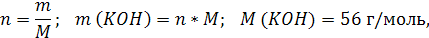 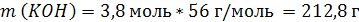 3. Определим массу 1 л (1000 мл) раствора: 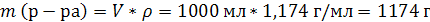 4. Определим массовую долю (%) едкого кали в растворе: 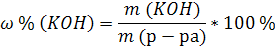 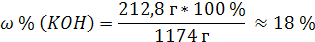 |
| Найти: ω % (KOH) | |
| Ответ: Массовая доля (%) KOH в растворе, молярность которого 3,8 моль/л, равна 18%. |
Предыдущая12345678Следующая
Дата добавления: 2016-10-17; просмотров: 23131; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Поделитесь с друзьями:
ПОИСК ПО САЙТУ:
ПОХОЖИЕ СТАТЬИ:
- 1 страница. Морской порт в современном значении этого понятия представляет собой специально построенное и оборудованное на побережье предприятие
- F Выполнение задания. – Для этого нажмите кнопку с изображением дискеты Сохранить на Панели быстрого доступа, а затем на кнопку Свернуть окна Word XP.
- Locatio conductio operis. Понятие и последствия этого договора
- Receptum nautarum, cauponum, stabulariorum. Понятие этого отношения
- А из этого следует первый вывод: прием сахарозаменителей провоцирует переедание!
- Административных правонарушениях. Перед тем как рассматривать основы производства по делам об административных правонарушениях и особенности этого производства в сфере таможенного дела дадим
- Адсорбция из растворов электролитов
пользователям VK интересно:
- Взаимосвязь юридической психологии с другими науками
- Биологическая роль буферных систем
- Плиты перекрытия
- Упражнений с гимнастической палкой
- Организация мероприятий по ликвидации незаразных болезней животных. Организация лечебных мероприятий
- Коррозионные диаграммы
- Дидактические принципы Каменского
- Кислотный и щелочной гидролиз пептидов.
- Производство строительной извести по мокрому способу из влажного мела
- Устройство и производительность дноуглубительных снарядов

Источник
