В какой массе содержится столько же эквивалентов
Материалы портала onx.distant.ru
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 А1(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Источник
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
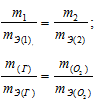
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
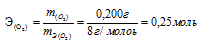
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
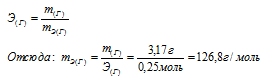
Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 егоэквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 .3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) .В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
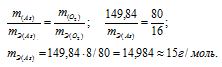
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 .2 = 149,84г; m(O2) = 16 .3 = 48г.
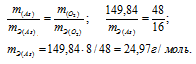
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
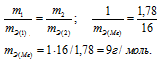
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
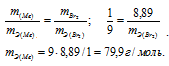
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда mэ(Cl2) = mэ(соли) – mэ(Cl2) = 99,5 – 35,5 = 64г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Отсюда CuxCly = CuCl.
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
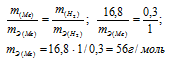
Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласнозакону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
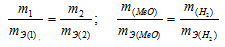
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение заменим равным ему отношением
заменим равным ему отношением  – объём водорода;
– объём водорода;
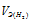 – эквивалентный объём водорода.
– эквивалентный объём водорода.
Тогда получим отношение 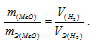
Находим эквивалентную массу оксида металла:
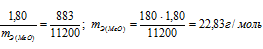
Согласно закону эквивалентов:
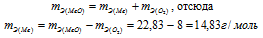
Ответ: 22,83г/моль; 14,83г/моль.
Источник
| Элемент или сложное вещество | ЭквивалентЭ, | Молярная масса (М экв.) эквивалента,[г/моль] |
| Элемент Например, Са | Ээл = 1? f =1/В Э (Ca) = 1/2 | Мэкв =M ? f = M/В М(½Ca) = 40/2 = = 20 г/моль |
| Кислота Например, H2S | Э кислоты = 1? f = = 1/основность Э кислоты = 1? f = =1/основность | Мэкв =M ? f = M/основность М(½Н2S).=34 ? 1/2 = = 17 г/моль |
| Основание Например, Са(OH)2 | Эосн = 1? f = = 1/кислотность Э [Ca(OH)2] = 1/2 | Мэкв =M ? f = = M/кислотность М[½Ca(OH)2] = = 74 / 2 = 37 г/моль |
| Соль Например, Al2S3 | Эсоли = 1? f = 1 / n ? В = = Э [Al2S3] = 1/2 ? 3 = 1/6 | Мэкв =M ? f = = M / n ? В М(1/6 Al2S3) = = 150 / 6 = 25 г/моль |
Эквивалент и молярная масса эквивалента сложного вещества определяются конкретной реакцией, в которой участвует данное вещество.
Пример 1.
Чему равен эквивалент и молярная масса эквивалента серной кислоты в реакциях с раствором щелочи, если образуется:
а) NаНSО4 и б) Nа2SО4?
Решение.
А) В реакции с образованием гидросульфата натрия серная кислота нейтрализуется не полностью:
Н2SО4 + NаОН = NаНSO4 + Н2О.
В этой реакции серная кислота проявляет основность равную 1. Из этого следует, что фактор эквивалентности этой кислоты в данной реакции равен 1. Найдем значение эквивалента кислоты в данной реакции:
Э (H2SO4) =1? f = 1/основность = 1.
Найдем значение молярной массы эквивалента кислоты:
Мэкв (H2SO4) =M ? f = M/основность = 98/1 = 98 г/экв,
б) Сульфат натрия образуется при полной нейтрализации кислоты:
Н2SО4 + 2NаОН = Na2SO4 +2Н2О.
В этой реакции основность, проявляемая Н2SO4, равна 2 и значение фактора эквивалентности в этом случае равно 2.
Отсюда:
Э (H2SO4) =1 ? f = 1/основность = 1/2 моль,
Мэкв (½H2SO4) = M/основность = 98/2= 49 г/моль.
Для газообразных веществ удобно пользоваться понятием молярный объем эквивалента (Vэкв).
Молярный объем эквивалента представляет собой объем одного моль эквивалентов газообразного вещества при нормальных условиях. Размерность молярного объема эквивалента [л/моль].
Так, 1 моль эквивалентов водорода (один моль атомов Н) имеет массу 1 г.
Пример 2.
Используя следствие из закона Авогадро, рассчитать объем, занимаемый одним эквивалентом водорода.
Решение.
1 моль молекул Н2 имеет массу 2 г и занимает объем 22,4 л, а объем, занимаемый одним эквивалентом водорода (одним моль атомов элемента водорода), который имеет массу 1 г, найдем из пропорции:
2 г Н2 → 22,4 л
1 г Н2 → х л
x = 11,2 л, т.е. Vэкв (H) =11,2 л/моль.
Аналогично можно рассчитать молярный объем эквивалента для кислорода, который будет равен:
Vэкв (½O) = 5,6 л/моль.
Введение в химию понятия «эквивалент» позволило сформулировать закон, называемый законом эквивалентов: массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:
где m1 и m2 – массы взаимодействующих веществ; Мэкв.1 и Мэкв.2 – молярные массы эквивалентов.
Если вещества находятся в газообразном состоянии, удобно пользоваться понятием «молярный объем эквивалента» и следующей формулировкой закона эквивалентов: объемы реагирующих друг с другом газообразных веществ пропорциональны молярным объемам их эквивалентов.
V1/V2 = Vэкв1/Vэкв2 , где
V1 и V2 – объемы реагирующих газообразных веществ,
Vэкв1 и Vэкв2 – молярные объемы их эквивалентов.
Пример 3.
Выразите в молях:
а) 6,02·1021 молекул СО2;
б) 1,20·1024 атомов кислорода;
в) 2,00·1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02·1023). Отсюда
а) 6,02·1021, т.е. 0,01 моль;
б) 1,20·1024, т.е. 2 моль;
в) 2,00·1023, т.е. 1 /З моль.
Масса моля вещества выражается в г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18 и 16 а.е.м., то их мольные (молярные) массы равны:
а) 44 г/моль;
б) 18г/моль;
в) 16 г/моль.
Пример 4.
Вычислите значение грамм-эквивалента серной кислоты, гидроксида кальция и сульфата алюминия.
Решение:
ЭH2SO4 =МH2SO4 /2=98/2=49г
ЭСа(OH)2 =МСа(OH)2 /2=74/2=37г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Пример 5.
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Решение.
Нормальные условия по Международной системе единиц (СИ): давление 1,013·105 Па (760 мм Т. Ст., 1 атм), температура 273 К или 0°С.
Согласно закону эквивалентов
m1/Мэ(1) = m2/Мэ(2)
m(МеО)/Мэ(МеО) = m(Н2)/Мэ(Н2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (мл, л, м 3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода (Vэ) молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. Отношение mH2 /МЭ(Н2) заменяем равным ему отношением VH2 /VЭ(Н2), где VH2 – объем водорода, VЭ(Н2) эквивалентный объем водорода:
m(МеО)/Мэ(МеО) = V(Н2)/Vэ(Н2)
Находим эквивалентную массу оксида металла МЭ(МеО)
7,09/МЭ(МеО) = 2,24/11,2; МЭ(МеО) = 7,09·11,2/2,24 = 35,45 г/моль.
Согласно закону эквивалентов МЭ(МeO) = МЭ(Мe) + МЭ(O2),
отсюда МЭ(Мe) = МЭ(МeО) – МЭ(O2) = 35,45 – 8 = 27,45 г/моль.
Мольная масса металла определяется из соотношения:
МЭ = А/В,
где: МЭ – эквивалентная масса, г/моль
А – мольная масса металла, г/моль
В – валентность элемента;
А = Мэ·В = 27,45•2 = 54,9 г/моль.
Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 6.
При 25 0С и давлении93 кПа. (745 мм Т. Ст.) некоторое количество газа занимает объем 152 мл. Найти, какой объем займет это же количество газа при 0 0С и давлении 101,33 кПа.
Решение.
Подставляя данные задачи в последнее уравнение, получаем:
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. 0,075 г металла вытесняет из раствора соли никеля 0,183 г никеля, а из раствора кислоты – 70 мл водорода, измеренного при нормальных условиях. Определите молярные массы эквивалентов металла и никеля. Ответ: 29,35 г/моль
2. При сгорании трёхвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите массу оксида. Ответ: Al2O3 ; 17 г/моль.
3. Определите молярные массы эквивалентов кислот и гидроксидов в реакциях:
H2SO4 + 2NaOH = Na2SO4 + 2H2O Ответ: 49 г/моль
2H3PO4 + Ca(OH)2 = Ca(H2PO4)2 + 2H2O Ответ: 98 г/моль
Al(OH)3 + 3NaCl = AlCl3 + 3NaOH Ответ: = 26 г/моль
Zn(OH)2 + NaCl = ZnOHCl + NaOH Ответ: 99,4 г/моль
4. На реакцию с 13,61 г дигидрофосфата калия израсходовано 5,61 г гидроксида калия. Вычислите молярную массу эквивалента дигидрофосфата калия и напишите уравнения реакции. Ответ: 136,1 г/моль
5. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (МЭ(Ме)). Ответ: 15 г/моль.
6. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в 312г А1(ОН)3? Ответ: 444г.
7. Вычислите абсолютную массу молекулы серной кислоты в граммах. Ответ: 1,63* 10-22
8. На восстановление 3,6 г оксида двухвалентного металла израсходовано 1,7 л водорода (н.у.). Вычислить молярные массы эквивалента оксида и металла. Ответ: 15,72 г.
9. Объемное содержание углекислого газа в воздухе составляет 0,03% (н.у.). Найти количество (моль) и массу (г) СО2, содержащегося в 0,5 м3 воздуха. Ответ: 0,295 г.
10. Масса колбы вместимостью 750 мл, наполненной при 27°С кислородом, равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определить давление кислорода в колбе. Ответ: 124,65 кПа.
11. При сгорании 5,00 г трехвалентного металла образовалось 9,45 г его оксида. Определите молярную массу эквивалента этого металла и назовите металл. Ответ: 27 г.
12. 0,978 г щелочного металла реагирует с 0,200 г кислорода и с 3,17 г галогена. Определите эквивалент галогена и назовите его. Ответ: галоген – I.
13. Чему равен эквивалент щелочноземельного металла и его оксида, если известно, что 0,608 г металла вытесняют из раствора соляной кислоты 0,560 л водорода (н.у.)? Определите металл. Ответ: металл – Mg.
14. 0,200 г двухвалентного металла вытеснили 197 см3 водорода, который был собран под водой и измерен при 20ºС и 780 мм Hg. Давление насыщенных паров воды при этих условиях составляет 17,4 мм Hg. Определите, какой это металл. Ответ: металл – Mg.
15. 3,16 г перманганата калия взаимодействуют с концентрированной соляной кислотой. Образующийся хлор пропустили в раствор иодида калия. Сколько граммов иода выделилось, если общий выход реакций составил 80 %? Ответ: 10,2 г.
16. Определите эквивалент и эквивалентные массы элементов в соединениях с водородом: H2O, HCl, PH3. Ответ: 8 г/моль, 35,5 г/моль, 10,3 г/моль.
17. Определите эквивалентные массы следующих соединений: CO2, H2SO4, Cu(OH)2, MgCl2.Ответ: 11 г/моль, 49 г/моль, 49 г/моль, 47,5 г/моль.
18. На нейтрализацию кислоты массой 2,18 г израсходовано KOH массой 2,49 г. Определите эквивалентную массу кислоты. Ответ: 49 г/моль.
19. Определите массу металла, вступившего в реакцию с кислотой, если при этом выделился водород объёмом 260 мл при нормальных условиях. Эквивалентная масса металла mэ(Ме) = 9 г/моль. Ответ: 0,2 г.
20. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла. Ответ: 15 г/моль.
21. При взаимодействии магния с кислородом образуется оксид магния. Определите массу магния, необходимую для реакции с кислородом массой 64 г, а также массу образующегося при этом оксида. Ответ: m (Мg) = 96 г, m (MgO) = 160г.
22. Чему равны массы цинка и серы, необходимые для получения сульфида цинка массой 485 г? Ответ: m (MgO) = 325 г, m (S) = 160 г.
23. Определите массу хлорида калия, образующегося при взаимодействии хлористого водорода массой 219 г с раствором, содержащим гидроксид калия массой 224 г. Ответ: 298 г.
24. При 25°С и давлении 745 мм Т. Ст. некоторое количество газа занимает объем 152 мл. Вычислить, какой объем займет это же количество газа при нормальных условиях. Ответ: 136,5 мл.
25. Чему равны значения а) относительной плотности хлора по воздуху, б) массы 1 л хлора (при н.у.), в) объема 1 л хлора (при н.у.). Ответ: а) 2,45; б) 3,17 г; в) 0,3 л.
26. При растворении металла массой 0,0548 г в избытке раствора кислоты выделялся водород объемом 50,4 мл (н.у.). Вычислите значение молярной массы эквивалента металла. Ответ: 12,17 г/моль.
27. Вычислить эквивалент и молярную массу эквивалента ортофосфорной кислоты в реакциях: а) с магнием, б) с гидроксидом калия, если при этом образуется кислая соль K2HPO4. Ответ: а) 32,67 г/моль; б) 49 г/моль.
28. При окислении металла массой 8,43 г образовался оксид массой 9,63 г. Вычислите значения молярных масс эквивалентов металла и его оксида. Ответ: 64,2 г/экв.
29. Вычислите значения относительной атомной массы и молярной массы эквивалента некоторого элемента, зная, что массовая доля данного элемента в его оксиде составляет 46,74 % и что на один атом его в оксиде приходится два атома кислорода. Ответ: 28,08 г/моль.
30. Масса 0,327 ·10-3 м3 газа, при 13 оС и давлении 1,04 ·105 Па равна 0,828 ·10-3 кг. Вычислить молярную массу газа. Ответ: 57,8 * 10-3 кг/моль.
Источник
