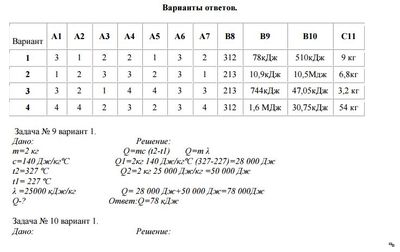
В каком из сосудов содержится только газ
Здесь находится описание темы Ответы к тесту по физике 4 варианта, изучаемой по предмету Физика. Ниже вы разберете ответы на все ваши разнообразные вопросы. Если представленный текст вам не помог, то вы смело можете задать свои вопросы ниже.
ВАРИАНТ 1
ЧАСТЬ А. Выберите один верный ответ
Расстояние между соседними частицами вещества мало (они практически
соприкасаются). Это утверждение соответствует модели
1) только твёрдых тел
2) только жидкостей
3) твёрдых тел и жидкостей
4) газов, жидкостей и твердых тел
2. При испарении жидкость охлаждается. Это объясняется тем, что…
o жидкость покидают частицы с наибольшей кинетической энергией
o масса жидкости уменьшается
o жидкость покидают самые лёгкие молекулы
o жидкость покидают самые медленные молекулы
3.Как изменяется внутренняя энергия стали при отвердевании?
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
4. Удельная теплота плавления платины равна 110 кДж/кг. Это значит, что при температуре
плавления …
1) для плавления 2 кг платины потребуется 110 кДж теплоты
2) для плавления 400 г платины потребуется 44 кДж теплоты
3) при кристаллизации 2 кг платины выделится 22 кДж теплоты
4) при кристаллизации 1 г платины выделится 110 кДж теплоты
5. При какой влажности воздуха человек легче переносит высокую температуру воздуха и
почему?
1) при низкой, т.к. при этом пот испаряется быстро
2) при низкой, т.к. при этом пот испаряется медленно
3) при высокой, т.к. при этом пот испаряется быстро
4) при высокой, т.к. при этом пот испаряется медленно
6. Как изменится удельная теплота плавления вещества при увеличении массы тела в 3 раза?
увеличится в 3 раза
уменьшится в 3 раза
не изменится
может увеличиться, может уменьшиться
7. На рисунке показан график зависимости температуры нагревания льда от времени. Какой
участок графика соответствует
процессу нагревания воды?
ЧАСТЬ В.
8. К каждой позиции первого столбца таблицы подберите позицию второго столбца так,
чтобы получились верные утверждения.
А. При температуре 100ºС 1) Вода
вещество будет только в газообразном
состоянии
Б. При равных массах, остывая 2) Ртуть
на 1ºС, выделит наибольшее
количество теплоты
В. При температуре 100ºС 3) Спирт
вещество будет только в жидком
состоянии
Решите задачи.
9. Какое количество теплоты потребуется для плавления 2 кг свинца, имеющего температуру
227ºС?
10. Какое количество теплоты выделится при конденсации 200 г водяного пара, взятого при
температуре 100ºС, и охлаждении образовавшейся воды до 40ºС?
ЧАСТЬ С.
11.Решите задачу.
При конденсации1 кг водяного пара, взятого при температуре 100ºС, выделяется энергия.
Какую массу воды можно нагреть от 0ºС до 60ºС
за счёт выделившейся энергии. Потерями тепла пренебречь. Ответ представьте целым
числом килограммов.
ВАРИАНТ 2
ЧАСТЬ А. Выберите один верный ответ
1. Атомы и молекулы вещества в любой момент времени расположены в пространстве
беспорядочно, на разных расстояниях друг от друга и беспрерывно и хаотично движутся,
изменяя взаимное расположение…
1) в газах
2) в жидкостях
3) в кристаллических телах
4) в любом агрегатном состоянии
2. Какой фактор не влияет на скорость испарения жидкости?
1) температура жидкости
2)масса жидкости
3) площадь поверхности
4) род вещества
3.Как изменяется температура жидкости от начала кипения до полного её выкипания?
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала увеличивается, а затем уменьшается
4. Три тела одинаковой массы, сделанные из разных веществ. Нагрели до температуры
плавления. Какое тело расплавится последним при сообщении им одинакового количества
теплоты, если удельные теплоты плавления веществ соответственно равны: 0,2 МДж/кг; 0,4
МДж/кг ; 0,6 МДж/кг.
1) первое
2) второе
3) третье
4) все одновременно
5.На поверхности земли выпала роса. Это значит, что в этот момент в воздухе
содержится
1) ненасыщенный пар
2) насыщенный пар
3) нет пара
4) перенасыщенный пар
6. Как изменится удельная теплота парообразования вещества при уменьшении массы
жидкости в 4 раза?
1) увеличится в 4 раза
2) уменьшится в 34раза
3) не изменится
4) может увеличится, может уменьшится
7. На рисунке показан график зависимости температуры нагревания льда от времени. Какой
участок графика соответствует процессу нагревания льда?
ЧАСТЬ В.
8. К каждой позиции первого столбца таблицы подберите позицию второго столбца так,
чтобы получились верные утверждения.
А. При температуре 78 ºС 1) Спирт
вещество будет только в газообразном
состоянии
Б. При равных массах для выпаривания 2) Кислород
потребуется наибольшее
количество теплоты
В. При температуре -114ºС 3) Ртуть
вещество будет только в твердом
состоянии
Решите задачи.
9. Какое количество теплоты потребуется для плавления 100 г олова, имеющего температуру
32ºС?
10. Какое количество теплоты выделится при конденсации 4 кг водяного пара, взятого при
температуре 100ºС, и охлаждении образовавшейся воды до 20ºС?
ЧАСТЬ С.
Решите задачу.
В сосуд с водой, имеющий температуру 0ºС, впустили 1 кг стоградусного водяного пара
. Через некоторое время в сосуде установилась температура 20ºС. Определите массу
воды первоначально находящейся в сосуде.
ВАРИАНТ 3
ЧАСТЬ А Выберите один верный ответ
Жидкость сходна с газом в том, что как и газ, при небольших внешних воздействиях
o Сохраняет форму
o Сохраняет объем
o Не сохраняет форму
o Не сохраняет объем
Энергия при конденсации пара выделяется вследствие
o Уменьшения температуры
o Уменьшения кинетической энергии молекул
o Совершения работы
o Теплопередачи
Лед при температуре 0ºС внесли в теплое помещение. Температура льда до того, как он
растает
o Не изменится, так как вся энергия, получаемая льдом в это время, расходуется на
разрушение кристаллической решетки
o Не изменится, так как при плавлении лед получает тепло из окружающей среды, а
затем отдает его обратно
o Повысится, так как лед получает тепло от окружающей среды, значит, его внутренняя
энергия растет и температура льда повышается
o Понизится, так как при плавлении лед отдает окружающей среде некоторое
количество теплоты
4. Удельная теплота парообразования спирта 0,9 МДж/кг. Это значит, что при температуре
кипения спирта
Для кипения 2 кг спирта потребуется 0,18МДж теплоты
Для кипения 200г спирта потребуется 180 МДж теплоты
При конденсации 2 кг спирта выделится 0,45 МДж теплоты
При конденсации 200г спирта выделится 0,18 МДж теплоты
o Почему в районах с высокой влажностью трудно переносить повышение
температуры воздуха?
o Пот испаряется быстро, тело человека охлаждается
o Пот испаряется быстро, тело человека нагревается
o Пот испаряется медленно, тело человека охлаждается
o Пот испаряется медленно, тело человека нагревается
6. Как изменится удельная теплота плавления при уменьшении массы тела в 2 раза?
Увеличится в 2 раза
Уменьшится в 2 раза
Не изменится
Может увеличиться, может уменьшиться
7. На рисунке показан график зависимости температуры нагревания льда от времени. Какой
участок графика соответствует процессу конденсации воды?
ЧАСТЬ В
8. К каждой позиции первого столбца
таблицы подберите позицию второго столбца так, чтобы получились верные утверждения.
А. При температуре 232ºС 1) Водород
вещество будет в двух агрегатных
состояниях
Б. При равных массах, нагреваясь 2) Олово
на 1ºС, поглощает наибольшее
количество теплоты
В. При плавлении 1кг вещества 3) Свинец
поглощает наименьшее количество теплоты
Решите задачи.
9. Какое количество теплоты выделится при отвердевании 2кг воды, взятой при температуре
10ºС?
10. Какое количество теплоты потребуется для обращения в пар 100г эфира, взятого при
температуре 5ºС ?
ЧАСТЬ С
11. Решите задачу.
Железная заготовка, охлаждаясь от температуры 800ºС до 0ºС, растопила лед массой 3кг,
взятый при 0ºС. Какова масса заготовки, если вся энергия, выделенная ею, пошла на
плавление льда?
ВАРИАНТ 4
ЧАСТЬ А Выберите один верный ответ
1. В каком агрегатном состоянии вещества его атомы и молекулы участвуют в тепловом
движении?
Только в газообразном
В газообразном и жидком
В жидком и твердом
В газообразном, жидком и твердом
2. При какой температуре молекулы могут покидать поверхность воды?
Только при температуре кипения
Только при температуре выше 100ºС
Только при температуре выше 20ºС
Только при температуре выше 0ºС
3. В процессе кипения жидкости в ней образуются пузырьки, Внутри пузырьков находится
Ненасыщенный пар
Насыщенный пар
Воздух
Ничего нет
4.Удельная теплота плавления меди 0,2 МДж/кг. Это значит, что при температуре плавления
меди
o Для плавления 4кг меди потребуется 20МДж теплоты
o Для плавления 4кг меди потребуется 0,8 МДж теплоты
o При кристаллизации 4 кг меди выделится 0,8 МДж тепла
o При кристаллизации 4 кг меди выделится 2 МДж тепла
5.Повышение влажности приводит к нарушению теплового обмена человека с окружающей
средой, это связано с тем, что при этом изменяется
Удельная теплоемкость воздуха
Скорость испарения влаги с поверхности тела
Атмосферное давление
Содержание кислорода в воздухе
6.Как изменится удельная теплота парообразования вещества при увеличении массы тела в 5
раз?
Увеличится в 5 раз
Уменьшится в 5 раз
Не изменится
Может увеличиться, может уменьшиться
7. На рисунке показан график зависимости нагревания льда от времени. Какой участок
графика соответствует процессу кристаллизации воды?
ЧАСТЬ В
ЧАСТЬ В
8. К каждой позиции первого столбца таблицы подберите позицию второго столбца так,
чтобы получились верные утверждения.
А. При температуре 0ºС вещество 1) Вода
будет только в твердом состоянии
Б. При кристаллизации 1кг выделит 2) Ртуть
наибольшее количество теплоты
В. При температуре 0ºС вещество 3) Нафталин
Будет только в жидком состоянии
Решите задачи.
9. Какое количество теплоты выделится при кристаллизации 4кг меди и охлаждении ее до
температуры 585ºС?
10. Какое количество теплоты потребуется для того, чтобы 30 г спирта, взятого при
температуре 28ºС, нагреть до кипения и обратить в пар?
ЧАСТЬ С
Решите задачу. 11. Какая масса льда, взятого при температуре 0ºС, расплавится, если ему
сообщить такое количество теплоты, которое выделится при конденсации стоградусного
водяного пара массой 8 кг?




Источник
Сохраните:
Ответы и задания для 6,7,8,9,10,11 класса 43-го турнира Ломоносова по химии 2020-2021 учебный год, официальная дата проведения турнира в онлайне: 04.10.2020 (4 октября 2020 год).
P.S свои ответы пишите в комментариях ниже, тем самым поможете другим ребятам, а они вам.
Ссылка для скачивания заданий для 6-11 класса: скачать задания
43 турнир М.В. Ломоносова по химии задания и ответы 6-11 класс 2020:
1)Рассчитайте молекулярную массу вещества, имеющего формулу Ca(HCO3)2. Атомные массы считайте целыми числами.
Ответ: 162
2)Рассчитайте, сколько протонов содержится в ядрах всех атомов, входящих в состав молекулы серной кислоты (H2SO4).
Ответ: 50
3)Школьник нашел моток проволоки из белого металла. Он предположил, что это оловянная проволока, тем более ему как раз требовалось олово для пайки. Но как убедиться в этом? К счастью недавно он как раз изучал в школе закон Архимеда, поэтому сразу сообразил, что нужно делать. Он взвесил проволоку и получил величину 841,3 г. Затем он полностью погрузил проволоку в воду и снова взвесил ее, на этот раз весы показали 726,3 г. Школьник произвел необходимые расчеты и убедился, что проволока действительно изготовлена из олова.
Определите по этим данным плотность олова. Приведите свой расчет.
Ответ: 7,3 г/см
Если бы проволока такой же массы (841,3 г) была изготовлена из алюминия, плотность которого 2,7 г см3, то сколько бы она весила в воде?
Ответ: 530,3
4)Водород взаимодействует с парами йода образуя газообразный иодоводород HI. В реакцию в замкнутом сосуде ввели некоторые количества H2 и I2. Через некоторое время состав смеси (в % по молям) стал таким: 30% HI, 10% H2 и 60% I2.
Определите мольное соотношение водорода и йода в первоначальной смеси.
Для реакции взяли такую же смесь водорода и паров йода, как в вопросе 1. Через некоторое время в смеси обнаружено 0,4 моль HI. Определите количества (в моль) водорода и йода, которые в этот момент остаются в сосуде, если известно, что количество водорода уменьшилось в ходе реакции на 50%.
5)Вещества А, Б, В и Г вступают в следующие реакции (многоточие означает, что в реакции образуются и другие продукты): А+K2CO3 + H2O = 2Б Б+HCl =А+….. А+2Mg =В+….. В+O2 =А А+В= 2Г. Определите вещества А, Б, В и Г, если известно, что они все содержат один и тот же элемент, причем его содержание в веществе А составляет 27,27%.
Ответ: A – CO2, Б – KHCO3, В – C, Г – CO
6)В лаборатории имеется пять колб с водными растворами различных веществ. Они подписаны: №1 хлорид аммония, №2 — соляная кислота, №3 — гидроксид калия, №4 — хлорид алюминия, №5 — карбонат натрия. Однако все этикетки перепутаны таким образом, что ни один из растворов не подписан правильно.
При сливании раствора №1 с раствором №4 выделяется газ, который окрашивает влажную индикаторную бумажку в синий цвет. При сливании растворов №2 и №3 выпадает осадок. А при сливании раствора №2 с раствором №5 никаких изменений не происходит.
- Укажите правильные надписи для колб №№ 1–5. Приведите необходимые рассуждения.
- Напишите уравнения реакций, упомянутых в условии.
- Какие еще реакции можно провести между указанными веществами? Напишите их уравнения.
Ответ: №1 карбонат натрия, №2 гидроксид калия, №3 хлорид аллюминия, №4 хлорид аммония, №5 соляная кислота. 2_NH4Cl + Na2CO3 = H2O + CO2 + 2_NaCl + 2_NH3 AlCl3+ 3_KOH = Al(OH)3 + 3_KCl KOH+ HCl= H2O+ KCl
7)Смесь, состоящую из металла А и не которого оксида Б, прокалили и получили смесь продуктов В и Г. При растворении смеси В и Г в избытке соляной кислоты была получена соль Д и выделился горючий газ Е с плотностью по водороду 16. К раствору, содержащему соль Д массой 4,75 г, добавили избыток раствора гидроксида натрия, выпавший при этом осадок отделили, высушили и прокалили, при этом было получено 2,0 г продукта Ж.
- Определите вещества А–Ж.
- Приведите необходимые расчеты
Ответ: А – магний Б – оксид кремния (IV) В – силицид магния Г – оксид магния Д – хлорид магния Е – силан Ж – оксид магния.
Mg+SiO2=Mg2Si+MgOMgO+2HCl=MgCl2+H2OMg2Si+4HCl=SiH4+2MgCl2MgCl2+2NaOH=Mg(OH)2+2NaClMg(OH)2=MgO+H2O
8)Смесь пропана и пропена пропустили в темноте через сосуд, содержащий раствор брома в четыреххлористом углероде. После пропускания газовой смеси масса сосуда увеличилась на 1,26 г. Газ, который не поглотился раствором брома, собрали и сожгли в кислороде. Продукты сгорания последовательно пропустили через трубки, содержащие избыток безводного оксида фосфора(V) и избыток сухого гидроксида калия. Масса первой трубки увеличилась на 2,52 г, а масса второй — на 5,28 г.
- Определите количество пропана в исходной смеси (в моль).
- Определите количество пропена в исходной смеси (в моль).
- Приведите необходимые расчеты.
9)Органическое вещество Х имеет следующий элементный состав: 61,31% C; 5,11% H; 23,36% O; и 10,22% N и молекулярную массу менее 180. Вещество Х можно получить из бензола в четыре стадии. Ниже приведены реагенты и условия, которые требуются на каждой стадии, но в произвольном порядке, не соответствующем реальной последовательности реакций.
- HNO3, H2SO4
- Zn, HCl
- C2H4, H3PO4
- KMnO4, H2SO4 (водный раствор)
В реакции, приведенной под номером 1, образуется два изомерных продукта, в реальных синтезах требуется их разделение. В качестве решения вы можете выбрать любой из изомеров.
- Определите вещество Х
- Расставьте стадии его получения в правильном порядке
- Определите промежуточные вещества, которые получаются на каждой стадии (запишите их названия).
04.10.2020 XLIII Турнир Ломоносова задания и ответы по всем предметам:
04.10.2020 XLIII Турнир Ломоносова задания и ответы
Источник
Задача 28.
При 17°С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100°С, если давление его останется неизменным?
Решение:
По закону Гей – Люссака при постоянном давлении объём газа изменяется прямо пропорционально абсолютной температуре (Т):
V2 – искомый объём газа;
T2 – соответствующая V2 температура;
V1 – начальный объём газа при соответствующей температуре Т1.
По условию задачи V1 = 580мл; Т1 = 290К (273 + 17 = 290) и Т2 = 373К (273 + 100 = 373). Подставляя эти значения в выражение закона Гей – Люссака, получим:
Ответ: V2 = 746мл.
Задача 29.
Давление газа, занимающего объем 2,5л, равно 121,6 кПа (912мм рт. ст.). Чему будет равно давление, если, не изменяя температуры, сжать газ до объема в 1л?
Решение:
Согласно закону Бойля – Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объёму газа:
Обозначив искомое давление газа через Р2, можно записать:
Ответ: Р2 = 304кПа (2280мм.рт.ст.).
Задача 30. На сколько градусов надо нагреть газ, находящийся в закрытом сосуде при 0 °С, чтобы давление его увеличилось вдвое?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально температуре:
По условию задачи Т1 = 0 °С + 273 = 273К; давление возросло в два раза: Р2 = 2Р1.
Подставляя эти значения в уравнение, находим:
Ответ: Газ нужно нагреть на 2730С.
Задача 31.
При 27°С и давлении 720 мм.рт. ст. объем газа равен 5л. Кой объем займет это же количество газа при 39°С и давлении 104кПа?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 5л; Т = 298К (273 + 25 = 298); Р = 720 мм.рт.ст. (5,99 кПа); Р0 = 104 кПа; Т = 312К (273 + 39 = 312); Т = 273К. Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 4,8л
Задача 32.
При 7°С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до —33 °С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 96,0 кПа; Т1 = 280К (273 + 7 = 280); Т2 = 240К (273 – 33 = 240). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 82,3кПа.
Задача 33.
При нормальных условиях 1г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 0 °С и )и давлении, равном 93,3 кПа (700мм. рт. ст.)?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V0 = 773мл; Т0 = 298К (273 + 25 = 298); Т = 273К; Р = 93,3кПа. Подставляя данные задачи и преобразуя уравнение, получим:
Ответ: V = 769, 07 мл.
Задача 34.
Давление газа в закрытом сосуде при 12°С равно 100 кПа (750мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 30°С?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 100 кПа; Т1 = 285К (273 + 12 = 285); Т2 = 303К (273 + 30 = 303). Подставляя эти значения в уравнение, получим:
Ответ: Р2 = 106,3кПа.
Задача 35.
В стальном баллоне вместимостью 12л находится при 0°С кислород под давлением 15,2 МПа. Какой объем кислорода, находящегося при нормальных условиях можно получить из такого баллона?
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: V = 12л; Т = 273К (273 + 0 = 2273); Р =15,2МПа); Р0 = 101,325кПа; Т0 = 298К (273 + 25 = 298). Подставляя данные задачи в уравнение, получим:
Ответ: V0 = 1,97м3.
Задача 36.
Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 17°С. Предельное давление для баллона 20,3МПа. При какой температуре давление азота достигнет предельного значения?
Решение:
При постоянном объёме давление газа изменяется прямо пропорционально абсолютной температуре:
Обозначим искомое давление через Р2, а соответствующую ему температуру через Т2. По условию задачи Р1 = 12,5МПа; Т1 = 290К (273 + 17 = 290); Р2 = 20,3МПа. Подставляя эти значения в уравнение, получим:
Ответ: Т2 = 1980С.
Задача 37.
При давлении 98,7кПа и температуре 91°С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях.
Решение:
Зависимость между объёмом газа, давлением и температурой выражается общим уравнением, объединяющим законы Гей-Люссака и Бойля-Мариотта:
где Р и V – давление и объём газа при температуре Т; Р0 и V0 – давление и объём газа при нормальных условиях. Данные задачи: Р0 = 101,325кПа; V = 680мл; Т0 = 298К (273 + 25 = 298); Т = 364К (273 + 91 = 364); Р = 98,7кПа. Подставляя данные задачи и преобразуя уравнение, получим:
<
Ответ: V0 = 542,3мл.
Задача 38.
При взаимодействии 1,28г металла с водой выделилось 380 мл водорода, измеренного при 21°С и давлении 104,5кПа (784мм рт. ст.). Найти эквивалентную массу металла.
Решение:
Находим объём выделившегося водорода при нормальных условиях, используя уравнение:
где Р и V – давление и объём газа при температуре Т = 294К (273 +21 = 294); Р0 = 101,325кПа; Т0 = 273К; Р = 104,5кПа. Подставляя данные задачи в уравнение,
получим:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 22,4 : 2 = 11,2л или 11200 мл. Тогда, используя формулу закона эквивалентов, рассчитаем эквивалентную массу металла:
Ответ: mЭ(Ме) = 39,4г/моль.
Задача 39.
Как следует изменить условия, чтобы увеличение массы данного газа не привело к возрастанию его объема: а) понизить температуру; б) увеличить давление; в) нельзя подобрать условий?
Решение:
Для характеристики газа количеством вещества (n, моль) применяется уравнение РV = nRT, или – это уравнение Клапейрона-Менделеева. Оно связывает массу (m, кг); температуру (Т, К); давление (Р, Па) и объём (V, м3) газа с молярной массой (М, кг/моль).
Тогда из уравнения Клапейрона-Менделеева объём газа можно рассчитать по выражению:
Отсюда следует, что V = const, если при увеличении массы (m) газа на некоторую величину будет соответственно уменьшена температура (T) системы на некоторое необходимое значение. Объём системы также не изменится при постоянной температуре, если при увеличении массы (m) газа на некоторую величину будет соответственно увеличено давление (P) системы на необходимую величину.
Таким образом, при увеличении массы газа объём системы не изменится, если понизить температуру системы или же увеличить давление в ней на некоторую величину.
Ответ: а); б).
Задача 40.
Какие значения температуры и давления соответствуют нормальным условиям для газов: а) t = 25 °С, Р = 760 мм. рт. ст.; б) t = 0 °С, Р = 1,013 • 105Па; в) t = 0°С, Р = 760 мм. рт. ст.?
Решение:
Состояние газа характеризуется температурой, давлением и объёмом. Если температура газа равна 0 °С (273К), а давление составляет 101325 Па (1,013 • 105) или 760 мм. рт. ст., то условия, при которых находится газ, принято считать нормальными.
Ответ: б); в).
Источник
