В каком количестве вещества бензола содержится

Наверно каждый человек помнит о таком веществе, как бензол, еще с курса органической химии. Данное углеводородное соединение было открыто химиком Фарадеем в 1825 г., однако название «бензол» оно приобрело еще в далеком XVII веке.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола – C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.
Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,50C;
температура кипения — 800C;
общая плотность вещества — 0,879 г/см3;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 250C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
3HС ≡ CH (Cакт., 550C) → C6H6
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
С6H6 + 3Cl2 → C6H5Cl + Hcl2;
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
C6H6 + C2H5Br → C6H5C2H5 + HBr3;
- нитрование и сульфирование бензола:
C6H6 + H2SO4 → C6H5SO3H + H2O,
C6H6 + HNO3 → C6H5NO2 + H2O;
- галогенирование бензола:
С6H5 – CH3 + Br = C6H5 – CH2Br + HBr;
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
C6H5CH3 + [O] → C6H5COOH.
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.
Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Источник
История
Во второй половине 17 века бензол был открыт Иоганном Рудольфом Глаубером, который также открыл глауберову соль при перегонке каменноугольной смолы. Однако полученный состав был ему неизвестен, поэтому он назвал его «нежным и прекрасным олеумом». В 1825 году английский физик Майкл Фарадей выделил это масло из жидких остатков, которые отделились от газовой фазы, когда китовый жир сжигали в лондонских уличных фонарях. В 1834 г. немецкий химик Эйльхард Мицчерлих получил бензол из бензойной кислоты и оксида кальция, а также преобразовал бензол в нитробензол и бензолсульфоновую кислоту. Он назвал это вещество «бензином» из-за его родства с бензойной кислотой. Кроме того, он создал правильную эмпирическую формулу C6H6. В 1845 году английский химик Чарльз Мэнсфилд выделил бензол из каменноугольной смолы, работая под руководством Августа Вильгельма фон Хофмана.
Возник долгий научный спор о правильной структурной формуле бензола. Первоначальные предложения, такие как призматическая структура Джеймса Дьюара, оказались ошибочными. Лишь в 1861 году австрийский школьный учитель Иоганн Йозеф Лошмидт сформулировал некоторые возможные структурные формулы бензола, которые немецкий химик Август Кекуле предложил в 1865 году в качестве предложения для структурной формулы. По легенде, эта идея пришла Кекуле во сне. В этом сне змеи по очереди кусали свои хвосты, создавая кольцевую структуру.
В 1872 году Кекуле сформулировал свою колебательную гипотезу о постоянном изменении одинарных и двойных связей. Только в 20 веке феномен делокализованных электронных облаков, которые придают молекуле бензола особую стабильность, можно было продемонстрировать с помощью рентгеноструктурного анализа.
Промышленное производство бензола из каменного угля началось в 1849 году.
Структурная формула
Бензол в определенной степени является прототипом всех ароматических соединений. Его необычное поведение для соединения, которое на самом деле должно содержать двойные связи, сделало выяснение его структуры одной из основных проблем в химии XIX века.
В 1865 году химику Августу Кекуле, наконец, удалось составить структурную формулу.
Каждый атом углерода имеет четыре валентных электрона, два из которых соединяют атом с соседними атомами углерода. Электрон связывает атом водорода. Остальные шесть электронов формально образуют три π-связи, что выражается двойными связями в структурной формуле. В орбитальной модели, шесть π-электронов скорее образуют облако делокализованных зарядов (делокализованная 6π-электронная система) выше и ниже уровня углеродного кольца. Кекуле выразил этот факт мезомерии двумя структурными формулами, каждая из которых символизирует только одну крайнюю точку зарядового облака. Из-за мезомерии углеродное кольцо более стабильно, чем гипотетический циклогексатриен с локализованными двойными связями, то есть с двойными связями в фиксированных положениях. В упрощенных обозначениях углеродное кольцо теперь представлено в виде шестиугольника, а электронное облако – в виде вписанного круга. Бензол – простейшая незаряженная ароматическая молекула.
Таким образом, бензол представляет собой равностороннее гексагональное кольцо, состоящее из 6 атомов углерода, все из которых являются вторичными и каждый имеет атом водорода. Однако подробные обозначения обычно опускаются:
Однако эта структура не объясняет специфического поведения бензола в реакции. Поэтому предполагалось, что сопряженные двойные связи подвержены постоянной миграции, то есть «не находятся в одном месте»:
Переворот π-электронов называется мезомерией и характерен для ароматических систем, но не ограничивается ими. Снимок таких мезомерных перестроек называется мезомерной граничной структурой.
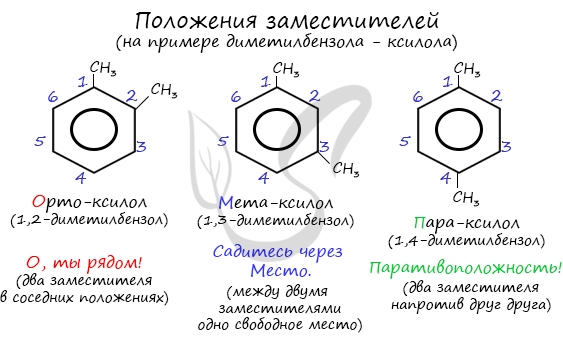
В случае дизамещенных продуктов, в зависимости от положения заместителей, различают
- орто (заместитель на атоме углерода 1 и 2);
- мета (заместители на атомах углерода 1 и 3 или 1 и 5);
- пара (заместители на атомах углерода 1 и 4) положения заместителей.
Свойства
Физические свойства
Бензол – бесцветная, прозрачная, летучая и легко воспламеняющаяся жидкость. Показатель преломления бензола довольно хорошо согласуется с показателем преломления оконного стекла, поэтому стекло, погруженное в бензол, практически не видно. Вязкость бензола ниже, чем у воды. Он замерзает при 5,5 градуса Цельсия и закипает при 80,1 градусе Цельсия. При комнатной температуре (20 градусов Цельсия) он имеет плотность 0,88 килограмма на литр.
Бензол хорошо растворим в неполярных органических растворителях, таких как эфир и спирт, но плохо в воде (максимум 1,7 грамма на литр).
Химические свойства
Бензол горит желтым пламенем с образованием воды и углекислого газа, причем сильное образование сажи указывает на высокое содержание углерода в соединении. Теплотворная способность бензола составляет 40 580 кДж на килограмм, энтальпия сгорания составляет 3257,6 кДж на моль для жидкого бензола и 3301 кДж на моль для газообразного бензола. Бензол имеет очень характерный запах. Порог запаха очень низкий и составляет от 1,5 до 900 миллиграммов на кубический метр воздуха.
Важным (узнаваемым) признаком является отсутствие реакции присоединения с бромистоводородной кислотой или бромной водой. Повышение реакционной способности по отношению к добавлению бромистого водорода в ряду четырех структурно подобных соединений циклогексана, циклогексена, циклогексадиена предполагает еще большую реакционную способность бензола, потому что в первых трех соединениях увеличение реакционной способности вызвано может быть определено более высокое количество двойных углеродных связей. В бензол не добавляется бромистоводородная кислота из-за его особой ароматической стабильности, которая возникает в результате делокализации электронов.
Опасность и меры предосторожности
Бензол легко воспламеняется. Пары бензола ядовиты при вдыхании, симптомы острого отравления проявляются только при относительно высоких концентрациях. Легкое отравление проявляется головокружением, тошнотой, сонливостью и апатией. Тяжелое отравление приводит к повышению температуры и нарушению зрения, вплоть до временной слепоты и потери сознания. Так называемая бензольная зависимость, которая может возникнуть при вдыхании бензола, приводит к чувству опьянения и эйфории. Бензол может быть смертельным при длительном воздействии.
Длительное употребление небольшого количества бензола в основном приводит к повреждению внутренних органов и костного мозга. Последнее приводит к снижению количества эритроцитов (анемия), что проявляется в сердцебиении, мерцании глаз, усталости, головокружении, бледности и головной боли. Бензол хранится в головном мозге, костном мозге и жировой ткани, медленно выводится через почки. Острая летальная доза (пероральная) для человека составляет 50 миллиграммов на килограмм. Бензол образует взрывоопасные смеси при объемной долей воздуха от 1,4 до 8%.
С бензолом следует обращаться с особой осторожностью, хранить при температуре от 15 C до 25 C.
Выбросы бензола
Бензол содержится в каменноугольной смоле и нефти. При курении сигарет выделяются небольшие количества паров бензола (10–100 мкг на сигарету), а также следы бензола образуются во время извержений вулканов и лесных пожаров. Половина бензола, присутствующего в атмосфере, разлагается через два-пять дней, поскольку он вступает в реакцию с гидроксильными радикалами (свободными группами ОН). Неполное сгорание органических материалов также приводит к образованию бензола, но в основном бензол выделяется из бензина через выхлопные газы (75% выбросов).
Производство
Бензол можно получить путем крекинга бензина или нефти. В большинстве случаев гексан дегидрируется до циклогексана, а затем до бензола. Другой способ получения бензола – термическое деалкилирование. Метильная группа используемого толуола отделяется при 780 градусах Цельсия и давлении 40 бар. Газ-носитель в реакторе на 90% состоит из водорода. После охлаждения, разделения газа и жидкости и очистки получают чистый бензол. Бензол также можно получить из молекул этина в присутствии катализатора.
Ежегодно во всем мире производится около 35 миллионов тонн бензола.
Производные бензола и важные заместители
В основе многих важных химических веществ лежит бензольное кольцо. К ним относятся, например:
Алкильные заместители:
- Метилбензол – толуол (растворитель)
- Диметилбензол (смесь изомеров) – ксилол (растворитель)
- 1,3,5-триметилбензол – мезитилен (растворитель)
Другие функциональные группы:
- Гидроксильная группа (-ОН), фенол (антисептик)
- Аминогруппа (-NH 2 ), анилин (для производства красителей)
- Алкоксигруппа (-OC n H 2n), анизол (в парфюмерии)
- Алкены (-C n H 2n-1 ), стирол (важный мономер для производства пластмасс и синтетических смол)
Использование
Сам бензол в прошлом часто использовался в качестве растворителя в химической промышленности, но теперь он в значительной степени заменен менее канцерогенными веществами – толуолом и ксилолом. Кроме того, из-за его легковоспламеняющихся свойств его добавляют в моторное топливо, что объясняет, почему 75% бензола в воздухе образуются из-за выбросов автомобилей.
В виде производных, таких как толуол, анилин или фенол, он используется в промышленности для производства текстиля, парфюмерии, фармацевтических препаратов, пластмасс и красителей. Ацетилсалициловая кислота и парацетамол также содержат бензольный каркас.
Источник
Арены – ароматические углеводороды, содержащие одно или несколько бензольных колец.
Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда – бензол – C6H6.
Общая формула их гомологического ряда – CnH2n-6.
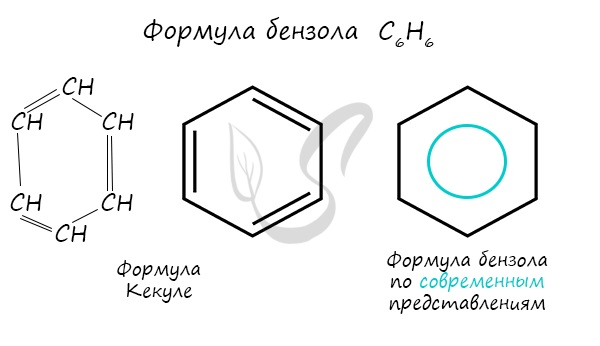
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла
объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям,
двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2
гибридизации. Валентный угол – 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи – бензольному кольцу: бензол, метилбензол (толуол),
этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей,
то выбирают кратчайший путь между ними.
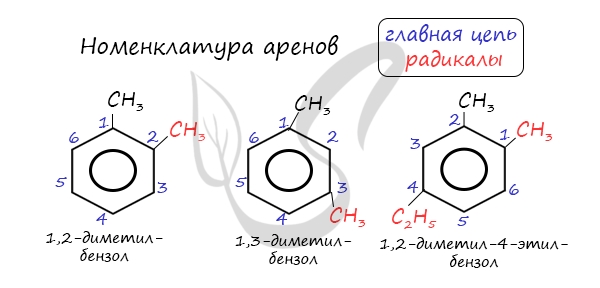
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном
кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается
приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания 😉
Получение аренов
Арены получают несколькими способами:
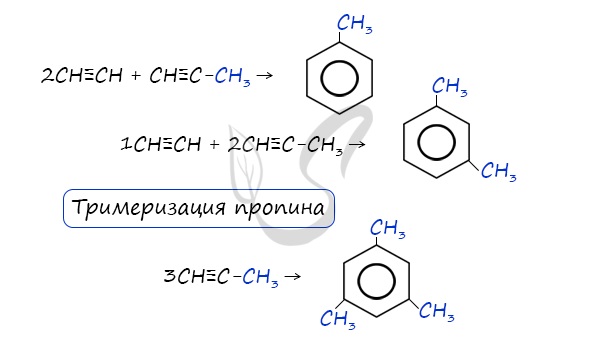
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический
углеводород – бензол.

В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге
можно добиться образования 1,3,5-триметилбензола.
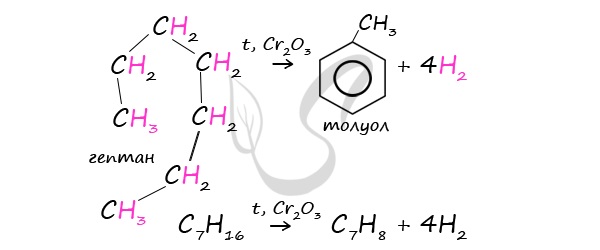
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора – Cr2O3, линейная
структура алкана замыкается в цикл, отщепляется водород.
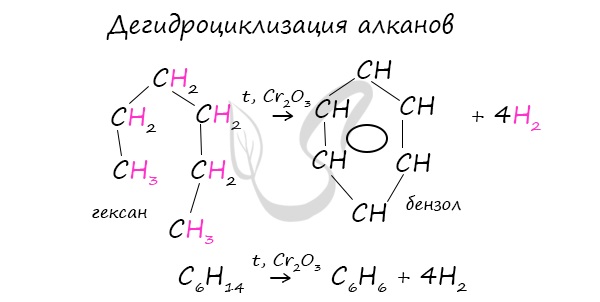
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже “готовых” циклов – циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен,
с теми же заместителями, которые были у циклоалкана.

Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
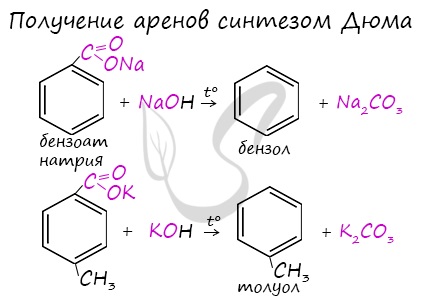
Химические свойства аренов
Арены – ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность
делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и
раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце
и превратить арен в циклоалкан.

Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор,
то образуется хлорбензол.
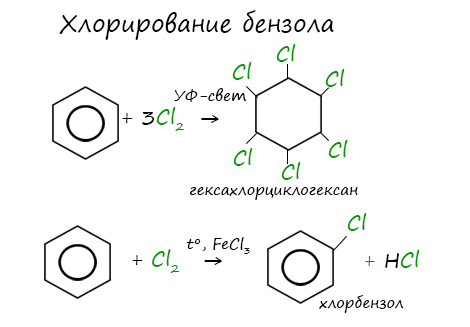
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
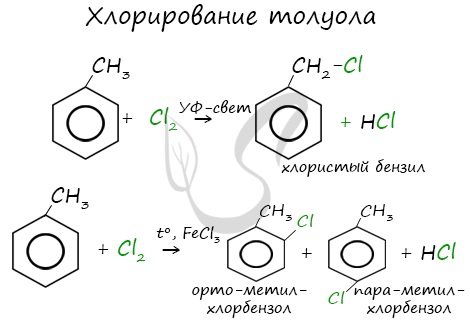
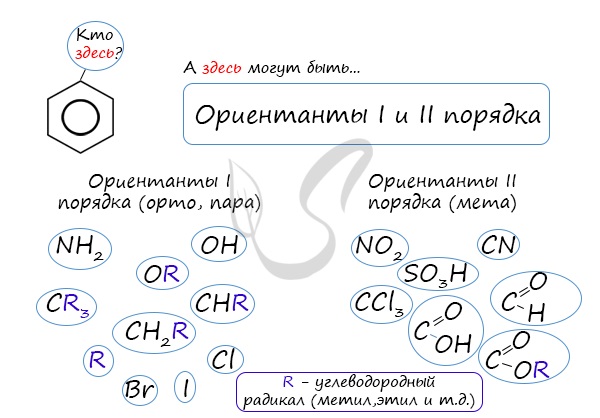
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время
коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2,
CH 2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3,
CHO, COOH, COOR.
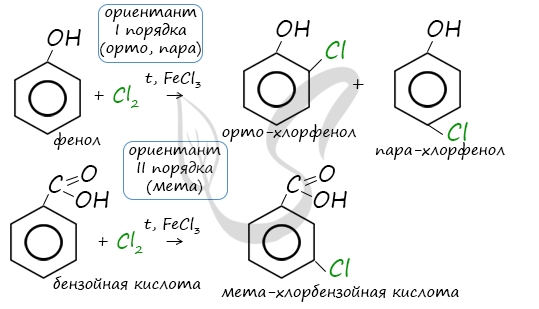
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях.
А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
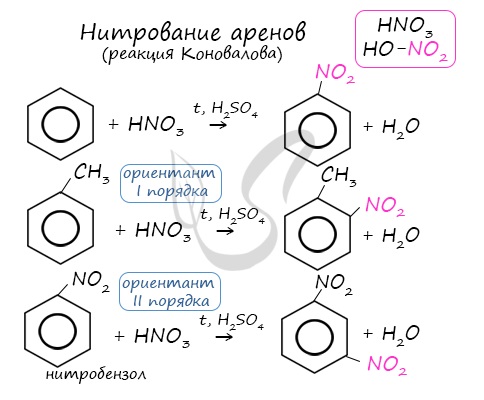
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты,
обладающей водоотнимающими свойствами.
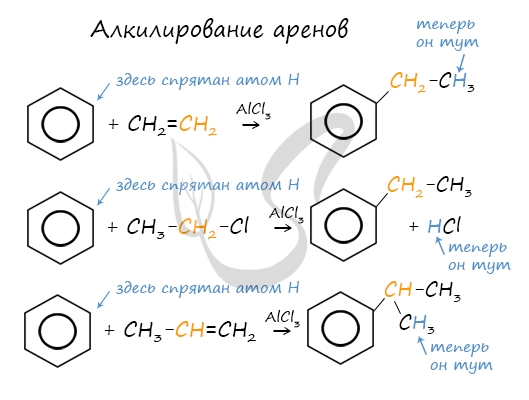
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще
всего выступает алкен или галогеналкан.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом
углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
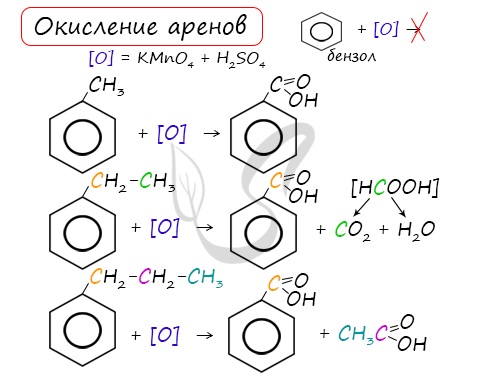
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
2C6H6 + 15O2 → 12CO2 + 6H2O
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной
кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
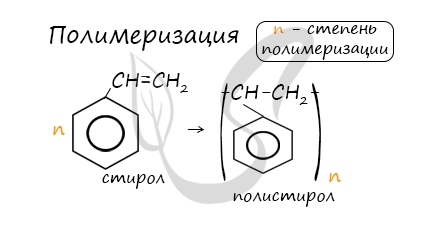
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
