В каком количестве вещества na2so4 содержится
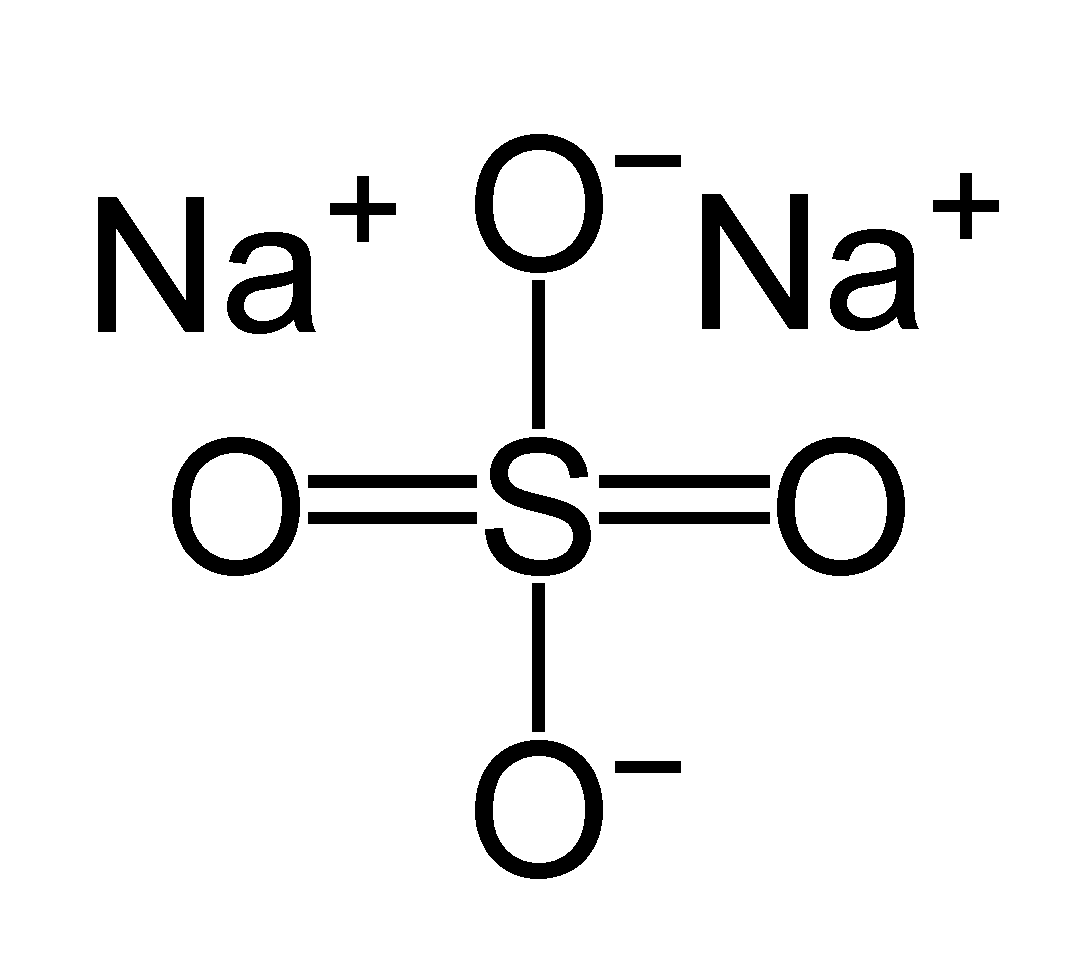
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 апреля 2018; проверки требуют 19 правок.
| Сульфат натрия | |
|---|---|
| Систематическое наименование | сульфат натрия, натрий сернокислый |
| Традиционные названия | глауберова соль, тенардит |
| Хим. формула | Na2SO4 |
| Рац. формула | Na2SO4 |
| Состояние | белые гигроскопичные кристаллы |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Температура | |
| • плавления | 883 °C |
| Энтальпия | |
| • образования | −1387,9 кДж/моль |
| Растворимость | |
| • в воде | 19,2 (20 °C), 42,3 (100 °C) |
| Рег. номер CAS | 7757-82-6 |
| PubChem | 24436 |
| Рег. номер EINECS | 231-820-9 |
| SMILES | [O-]S(=O)(=O)[O-].[Na+].[Na+] |
| InChI | InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 PMZURENOXWZQFD-UHFFFAOYSA-L |
| Кодекс Алиментариус | E514(i) и E514 |
| RTECS | WE1650000 |
| ChEBI | 32149 |
| ChemSpider | 22844 |
| NFPA 704 | 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
Свойства[править | править код]
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
- При высоких температурах восстанавливается до сульфида натрия методом карботермии (нагреванием с углем):
- Раствор сульфата натрия реагирует с растворами солей бария (например, BaCl2), образуя нерастворимый сульфат бария:
Нахождение в природе[править | править код]
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение[править | править код]
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение[править | править код]
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тысяч тонн сульфата натрия.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют в больших объёмах при получении целлюлозы сульфатным методом, а также в текстильной, кожевенной промышленности и в цветной металлургии.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Водные растворы сульфата натрия используются для лечения отравления растворимыми солями бария.
Зарегистрирован в качестве пищевой добавки E514.
Регулятор кислотности, используется как буферная добавка поддерживающая pH на определенном уровне [1].
Физиологическое действие и указания по технике безопасности[править | править код]
Сульфат натрия Na2SO4 пожаро- и взрывобезопасен. По степени воздействия на организм человека натрий сернокислый относится к IV классу опасности (малоопасные вещества) согласно ГОСТ 12.1.007-76. По токсикологии NFPA 704 сульфату натрия присвоена низшая токсичность.
См. также[править | править код]
- Глауберова соль
Примечания[править | править код]
Литература[править | править код]
- Реми Г. Курс неорганической химии. Т.2. — М., 1966
Ссылки[править | править код]
Источник
