В каком объеме 1 м раствора содержится 114 г сульфата алюминия

Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
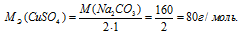
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
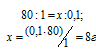
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) – нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) – объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
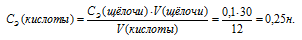
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
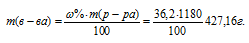
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
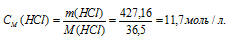
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
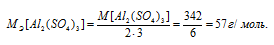
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
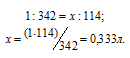
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
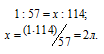
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
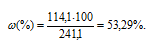
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
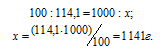
Теперь рассчитаем моляльность раствора:
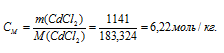
Ответ: 53,3%; 6,22 моль/кг.
Источник
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
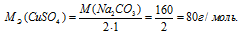
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
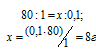
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) – нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) – объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
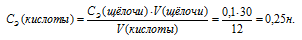
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
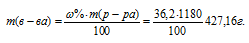
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
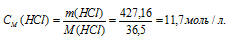
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
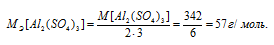
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
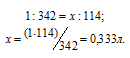
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
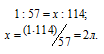
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
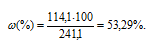
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
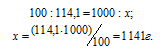
Теперь рассчитаем моляльность раствора:
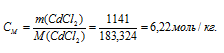
Ответ: 53,3%; 6,22 моль/кг.
Источник
Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?
• Масса 1 л раствора равна
ρp=1,105 г/мл
CM –? • Рассчитаем массу Al2(SO4)3 в 1105 г раствора, исходя из формулы (1):
• Молярная масса , следовательно, молярная концентрация сульфата алюминия исходя из формулы (4):
Пример 2. Чему равна массовая доля 0,2 М раствора (NH4)2SO4 с плотностью 1,015 г/мл?
• Масса 1 л раствора равна
ρp=1,015 г/мл
– ? • Рассчитаем массу (NH4)2SO4 в 1 л раствора,
используя формулу (4) (молярная масса ):
• Массовая доля сульфата алюминия в растворе по формуле (1) :
Пример 3. Смешали 50 мл 10 %-го раствора серной кислоты плотностью 1,069 г/мл и 150 мл 30 %-го раствора той же кислоты, плотностью 1,224 г/мл. Чему равна массовая доля кислоты в конечном растворе?
Условная схема приготовления конечного раствора:
раствор 1 (10 %) + раствор 2 (30 %) = раствор 3 (? %)
• Массовая доля серной кислоты, исходя из (1):
ρp1=1,069 г/мл
Vp1= 50 мл • Исходя из того, что масса конечного раствора складывается
из масс исходных растворов, а масса растворенной в нем
ρp2=1,224 г/мл кислоты – из масс кислоты в исходных растворах, получаем:
Vp2= 150 мл
• Используя значения плотностей растворов и выражение (1), найдем массы исходных растворов и растворенной в них серной кислоты:
• Найдем массовую долю серной кислоты в конечном растворе:
.
Пример 4. Какой объем 40 %-го раствора азотной кислоты плотностью 1,251 г/мл и воды потребуется для приготовления 500 мл 20 %-ой кислоты плотностью 1,119 г/мл?
Условная схема приготовления раствора:
раствор 1 (40 %) + вода = раствор 2 (20 %)
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1=1,251 г/мл
• В полученном выражении неизвестна масса кислоты, но при
ρp2=1,119 г/мл разбавлении исходного раствора водой масса растворенной
Vp2= 500 мл кислоты не изменяется, поэтому ее можно вывести из
Vp1– ? мл выражения массовой доли раствора 2:
• Рассчитаем объем исходного раствора:
• Исходя из схемы получения конечного раствора:
Пример 5. Какой объем 10 %-го раствора КОН плотностью 1,082 г/мл потребуется для приготовления 2 л 1 М раствора?
Условная схема приготовления раствора:
раствор 1 (10 %) + вода = раствор 2 (1 М)
• Необходимый объем исходного раствора кислоты выразим из (2):
ρp1=1,082 г/мл
• В полученном выражении неизвестна масса щелочи, но при
Vp2= 2 л разбавлении исходного раствора водой масса растворенной
Vp1– ? мл щелочи не изменяется, поэтому ее можно вывести из
выражения молярной концентрации раствора 2:
;
• Рассчитаем объем исходного раствора:
5.2. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1. Какой объем 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) требуется для приготовления 2 л 5 %-го раствора той же кислоты (ρ = 1,02 г/мл)?
2. Определить молярную концентрацию концентрированной соляной кислоты
(ρ = 1,183 г/мл), содержащей 36 % хлороводорода.
3. Какой объем 50 %-го раствора KOH (ρ = 1,538 г/мл) требуется для приготовления 3 л 10 %-го раствора (ρ = 1,082 г/мл)?
4. Плотность 32 %-го раствора KOH равна 1,31 г/мл. Сколько моль KOH находится в 3 л раствора?
5. Какой объем 28 %-го раствора серной кислоты (ρ = 1,21 г/мл) можно приготовить из 100 г 92 %-го раствора?
6. К 1 л 6 %-го раствора серной кислоты (ρ = 1,04 г/мл) добавили 1 л воды. Вычислить молярную концентрацию полученного раствора.
7. Какой объем 50 %-го раствора H2SO4 (ρ = 1,4 г/мл) требуется для приготовления 2 л 1 М раствора?
8. Смешали 50 мл 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) и 150 мл 30 %-го раствора той же кислоты (ρ = 1,152 г/мл). Какова массовая доля HCl в полученном растворе?
9. Сколько граммов K2SO4 необходимо для приготовления 500 мл 0,1 М раствора?
10. Какой объем 20 %-го раствора NaОН плотностью 1,225 г/мл потребуется для приготовления 1 л 2 М раствора?
11. Смешали 500 г 10 %-го раствора и 300 г 30 %-го раствора H2SO4. Какова процентная концентрация полученного раствора?
12. Смешали 50 мл 30 %-го раствора азотной кислоты плотностью 1,286 г/мл и 50 мл 50 %-го раствора той же кислоты плотностью 1,316 г/мл. Чему равна массовая доля кислоты в конечном растворе?
13. Какой объем 1 М раствора хлорида натрия можно приготовить из 20 г безводного NaCl?
14. Какой объем 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) необходим для приготовления 3 л 1,5 М раствора?
15. К 1 л 10 %-го раствора NaOH (ρ = 1,115 г/мл) прибавили 3 л воды. Какова процентная концентрация полученного раствора?
16. Какая масса сульфата натрия требуется для приготовления 500 мл 0,2 М
раствора?
17. 100 мл 2 М раствора разбавили водой до 400 мл. Какова молярная концентрация раствора?
18. Из 600 г 5 %-го раствора соды (Na2CO3) выпариванием удалили 100 г воды. Какова массовая доля Na2CO3 в полученном растворе?
19. Вычислить объем 10 %-го раствора NaOH (ρ = 1,115 г/мл), который требуется для приготовления 1 л 1 М раствора.
20. В каком объеме 0,2 М раствора содержится 10 г NiSO4?
21. Смешали 20 мл 20 %-го раствора азотной кислоты (ρ = 1,119 г/мл) и 100 мл 30 %-го раствора той же кислоты (ρ = 1,184 г/мл). Вычислить процентную концентрацию полученного раствора.
22. Какая масса хлорида натрия содержится в 100 мл 1 М раствора?
23. Какой объем 10 %-го раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 3 л 5 %-го раствора (ρ = 1,05 г/мл)?
24. Вычислить молярную концентрацию 25 %-го раствора сульфата цинка
(ρ = 1,3 г/мл).
25. Какой объем 30 %-й соляной кислоты (ρ = 1,152 г/мл) нужно взять для приготовления 1 л 2 М раствора?
26. Какой объем воды надо прибавить к 100 мл 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) для получения 20 %-го раствора?
27. Какая масса KNO3 должна быть растворена в 500 мл воды для получения 5 %-го раствора?
28. К 2 л 10 %-го раствора азотной кислоты (ρ = 1,054 г/мл) добавили 3 л
4 %-го раствора той же кислоты (ρ = 1,022 г/мл). Вычислить процентную концентрацию полученного раствора.
29. Вычислить молярную концентрацию 20 %-го раствора сульфата железа (II) (ρ = 1,21 г/мл).
30. К 50 мл 96 %-го раствора азотной кислоты (ρ = 1,5 г/мл) прилили 30 мл 9,9 М раствора той же кислоты (ρ = 1, 3 г/мл). Какова процентная концентрация полученного раствора?
Источник
Задача 421.
Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1л 0,25 н. раствора?
Решение:
Определим молярную массу эквивалента H2SO4 из соотношения:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
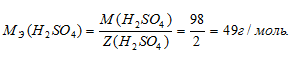
Рассчитаем массу H2SO4 в 1л 0,25н раствора по формуле:
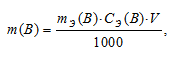
где
m(B) – масса вещества; mЭ(В) – молярная масса эквивалента вещества, г; СЭ(В) – эквива-лентная концентрация или нормальность; V – объём раствора.
Отсюда
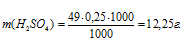
Теперь рассчитаем массу раствора, если известны массовая доля H2SO4 (96%) и масса H2SO4 (12,25г) по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
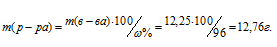
Определим объём раствора H2SO4, необходимого для приготовления 1л 0,25н раствора по формуле: m = pV, где p – плотность раствора, V – объём раствора.
Тогда
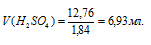
Ответ: 6,93 мл.
Задача 422.
Сколько миллилитров 0,5М раствора H2SO4 можно приготовить из 15 мл 2,5М раствора?
Решение:
Для нахождения массы серной кислоты, содержащейся в 15мл 2,5М раствора, можно определить по формуле:
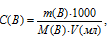
где
С(В) – молярная концентрация вещества (В), m(B) – масса растворённого вещества (В), М(В) – молярная масса вещества (В), V – объём раствора.
Тогда
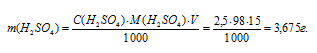
По этому же уравнению рассчитаем объём раствора, который можно приготовить из 3,675г H2SO4:
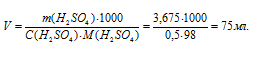
Ответ: 75мл.
Задача 423.
Какой объем 0,1М раствора H3PO4 можно приготовить из 75 мл 0,75н. раствора?
Решение:
Для решения задачи используем формулы:
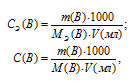
где
СЭ(В) – молярная концентрация эквивалента вещества (В);
С(В) – молярная концентрация вещества (В);
МЭ(В) – молярная масса эквивалента вещества (В);
M(B) – молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Определим молярную массу эквивалента H3PO4 из соотношения:
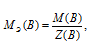
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H3PO4 → 3.
Отсюда
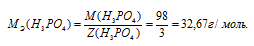
Рассчитаем массу ортофосфорной кислоты:
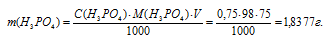
Определим объём раствора H3PO4, необходимого для приготовления раствора:
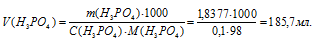
Ответ: 185,7мл.
Задача 424.
Какой объем 6,0М раствора НСI нужно взять для приготовления 25 мл 2,5М раствора НСI?
Решение:
Для нахождения массы соляной кислоты, содержащейся в 25 мл 2,5М раствора, а также объёма 6,0М раствора можно использовать формулу:
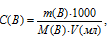
С(В) – молярная концентрация вещества (В);
M(B) – молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Тогда
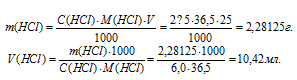
Ответ: 10,42мл.
Задача 425.
Плотность 40%-ного (по массе) раствора HNO3 равна 1,25г/мл. Рассчитать молярность и моляльность этого раствора.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Массу HNO3, содержащуюся в 1 литре раствора, рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
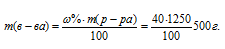
Молярную концентрацию раствора (CM) получим делением числа граммов HNO3 в 1л раствора на молярную массу HCl (36,5г/моль):
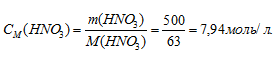
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:
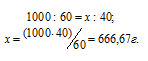
Теперь рассчитаем моляльность раствора:
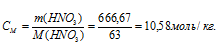
Ответ: 7,94 моль/л; 10б=,58 моль/л.
Задача 426.
Вычислить массовую долю гидроксида натрия в 9,28н. растворе NaOН (р = 1,310г/мл).
Решение:
Найдём массу NaOН, содержащуюся в 1000 мл раствора из пропорции:
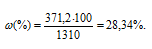
Масса 1 литра раствора NaOН (р = 1,310г/мл) равна 1310г (1000 . 1,310 = 1310).
Массовую долю гидроксида натрия вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
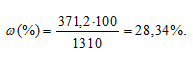
Ответ: 28,34%.
Источник
Эквиваленты
Эквивалент – реальная или условная частица вещества, которая химически равноценна одному иону водорода (для обменных реакций) или одному электрону (для окислительно-восстановительных реакций).
Фактически это частица, обладающая одной единицей валентности или оперирующая одним электроном.
Формулы для вычисления эквивалентов:

, где В – валентность химического элемента




Эквивалент элемента – такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалент Э часто обозначают Мэкв – эквивалентная масса.
[Мэкв]=г/моль.
Для атомов элементов с переменной валентностью необходимо предвидеть схему химического процесса, в котором предполагается использовать вещество с целью установления валентности в данном случае.
Фактор эквивалентности – число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной обменной реакции или одному электрону в данной окислительно-восстановительной реакции.
Например, в обменной реакции хлорида железа (III) с гидроксидом натрия возможны три варианта обмена:
FeCl3 + NaOH = FeOHCl2 + NaCl (1)
FeCl3 + 2NaOH = Fe(OH)2Cl + 2NaCl (2)
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl (3)
В реакции (1) эквивалентная масса хлорида железа (III) равна молярной массе, в реакции (2) она равна Ѕ*M(FeCl3), в реакции (3) – 1/3*M(FeCl3).
Мэкв(FeCl3) = f* M(FeCl3), где f – фактор эквивалентности.
В рассмотренных случаях он равен 1, Ѕ или 1/3 соответственно для трех уравнений реакций.
Фактор эквивалентности окислителя (восстановителя) – величина, обратная количеству электронов, которое присоединяет (отдает) в данной окислительно-восстановительной реакции одна молекула или один ион окислителя (восстановителя).
Для процессов, связанных с перераспределением электронов, важно знать частицу, способную отдать или принять один электрон.
8HNO3 + 2HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
+5 +1
окислитель 2N + 8e 2N *1 пр.восстановления
0 +2
восстановитель Мg – 2e Mg *4 пр.окисления
Молярная масса эквивалента азотной кислоты как окислителя равна ј ее молярной массы, т.е. фактор эквивалентности ее в этом процессе равен ј.
При расчетах по уравнениям химических реакций необходимо применять закон эквивалентов.
Закон эквивалентов:
- – вещества взаимодействуют друг с другом в количествах пропорциональных их эквивалентам;
- – массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам).
Массы веществ, участвующих в химическом процессе, относятся как их эквивалентные массы:


или или n1экв = n2экв.
Задачи, в решении которых используется понятие «эквивалент»
1. Неизвестный трехвалентный металл массой 0,36 г при обработке избытком раствора серной кислоты выделяет 448 мл (н.у.) водорода. Определите, какой металл вступил в реакцию с серной кислотой.
Решение:
1) Вычисляем объем, который при нормальных условиях занимает эквивалентная масса водорода.
Vэкв(H2)
Молярная масса водорода 2 г/моль, а объем при н.у. – 22,4 л/моль. Эквивалентная масса водорода равна 1 г/моль и, следовательно, эквивалентный объем – Vэкв(H2) = 11,2 л/моль. Отсюда можно вывести формулу для расчета эквивалентной массы неизвестного металла.

2) Вычисляем эквивалентную массу неизвестного металла

Mэкв(Me) = 9 г/моль
3) Вычисляем молярную массу металла
M(Me) = Mэкв(Me)/f = 9/(1/3) = 27 г/моль
Ar = 27
Ответ: алюминий Al.
2. При взаимодействии 2,6 г неизвестного двухвалентного металла с кислотой было получено 896 мл водорода (н.у.). Какой металл взаимодействовал с кислотой?
Решение:
Me– 2з Me+2
2H+1 + 1з * 2 H2
Me + 2H+ Me2+ + H2
;
г/моль


г/моль
Ответ: металл – цинк Zn.
3. Выведите формулу оксида неизвестного металла, если 1,775 г его при растворении в разбавленной серной кислоте образуют 3,775 г сульфата этого металла.
Решение:
1. Mэкв(оксида) = Mэкв(Me) + Mэкв(O), а эквивалентная масса сульфата равна сумме эквивалентных масс иона металла и сульфат-иона.
Mэкв(сульфата) = Mэкв(Ме) + Mэкв(SO4)
2. Вычисляем эквивалентную массу метала, обозначив ее через x.

,
но Mэкв(оксида) = (x + 8) г/моль,
а Mэкв(сульфата) = (x + 48) г/моль
и

3. Вычисляем молярную массу металла:
M(Me) = Mэкв(Me) / f = 27,5 / 1 = 27,5 г/моль.
При f = 1 -такого металла нет; при f = 1/2M(Me) = Mэкв(Me) / f = 27,5 / 0,5 = 55 г/моль
Это марганец.
Ответ: оксид марганца (II) MnO.
4. Вычислите эквивалентную массу серной кислоты, если в реакции с гидроксидом калия получается гидросульфат.
Решение:
H2SO4 + KOH = KHSO4 + H2O
из приведенной записи видно, что в реакции с одним молем КОН участвует 1 моль серной кислоты, и фактор эквивалентности равен 1.
Находим эквивалентную массу серной кислоты:
Мэкв(H2SO4)=f*М(H2SO4)=1*98г/моль=98г/моль
Ответ: Мэкв(H2SO4) =98г/моль
5. Вычислите эквивалентную массу ортофосфорной кислоты, если в реакции ее с гидроксидом натрия образуется гидрофосфат натрия.
Решение:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Mэкв(H3PO4) = Ѕ* M(H3PO4) = Ѕ * 98 г/моль = 49 г/моль.
(молярная масса эквивалента (эквивалентная масса)).
Ответ: Mэкв(H3PO4) = 49 г/моль
6. Вычислите эквивалентную массу сульфата алюминия, если при взаимодействии с щелочью образуется дигидросульфат алюминия.
Решение:
Al2(SO4)3 + 4NaOH = [Al(OH)2]SO4 + 2Na2SO4
Mэкв(Al2(SO4)3) = ј * M(Al2(SO4)3) = 342г/моль / 4 = 85,5 г/моль
Ответ: Mэкв(Al2(SO4)3) = 85,5 г/моль
7. Вычислить эквивалент и эквивалентную массу сероводорода, если он окисляется до серной кислоты.
Решение:
Н2S + 4 H2O = SO42- + 10H+ +8e
f=1/8
M(Н2S)=34 г/моль, Мэкв(Н2S)=f* M(Н2S)=1/8 *34=4,25 г/моль
Ответ: Мэкв(Н2S)=4,25 г/моль
- 8. Вычислить эквивалентную массу серной кислоты в следующих реакциях:
- а) Zn + H2SO4(разб) = ZnSO4 + H2;
- б) 2НBr + H2SO4(конц) =Br2 + SO2 + 2H2O;
- в) 8HI + H2SO4(конц) =I2 + H2S + 4 H2O.
Решение:
а) Мэкв(Н2SO4)=f* М(Н2SO4); f=1/2 Мэкв(Н2SO4)=f* М (Н2SO4)
Мэкв(Н2SO4)=49г/моль
б) SO42- +4Н+ +2е SO2 + Н2О; f=1/2
Мэкв(Н2SO4)=49г/моль
в) SO42- +10Н+ +8е Н2S + 4Н2О; f=1/8
Мэкв(Н2SO4)=12,25г/моль
9. Вычислить эквивалентные массы следующих восстановителей: хлорида олова (II); фосфора, если он окисляется до Н3РО4; пероксида водорода, окисляющегося до молекулярного кислорода.
Решение:
а) SnCl2 Mэкв=f*М(в-ва)

Sn2+ – 2e Sn4+ f=1/2 Mэкв(SnCl2)=г/моль

б) Р0 – 5е Р+5 f=1/5 Мэкв(Р)=г/моль

- в) 2О-1 -2е О20 f=1/2 Мэкв(H2O2)= г/моль
- 10. Чему равны эквивалент и эквивалентная масса перхлората калия КСlО4, если он восстанавливается: а) до диоксида хлора; б) до свободного хлора; в) до хлорид-иона?
Решение:
а) СlО4– +4Н+ + 3е ClO2 + 2H2O
f=1/3 Mэкв(КСlO4)=1/3*138,5=46,17г/моль
б) 2СlО4– +16Н+ + 14е Cl2 + 8H2O
f=1/7 Mэкв(КСlO4)=1/7*138,5=19,79г/моль
в) СlО4-+8Н+ + 8е Cl– + 4H2O
f=1/8 Mэкв(КСlO4)=1/8*138,5=17,3г/моль
11. Сколько эквивалентов КI необходимо для восстановления в кислой среде 1 моля: а) К2Сr2О7; б) КМnО4?
Решение:
- а) Сr2О72- +14Н+ +6е 2Сr3+ + 7Н2О * 1
- 2I- – 2e I2 * 3
По определению фактора эквивалентности восстановителя f для КI равен 6 моль.
- б) МnО4- + 8Н+ +5е Мn2+ + 4Н2О * 2
- 2I- – 2e I2 * 5
f для КI равен 5 моль.
Нормальная концентрация (нормальность) – число эквивалентов растворенного вещества, содержащееся в 1 л раствора.

Нормальная концентрация – это отношение количества вещества эквивалента к объему раствора: ; [CH]=моль/л.
Тип 1
Уровень 1
Задачи, при решении которых используется понятие «молярная концентрация»
1.1.1. Какова нормальность раствора, если в 300 мл его содержится 0,24 г NaOH?
Решение:
Мэкв(NaOH)=40 г/моль
n экв(NaOH)=

Сн(NaOH)=

Ответ: Сн(NaOH)=0,02н
1.1.2. Определите массу серной кислоты, которая содержится в 3500 мл 0,4 н раствора?
Решение:
n экв(Н2SO4)=Сн*V =0,4 * 3,5 =1,4 моль

Мэкв(Н2SO4)=г/моль
m(Н2SO4)=1,4моль * 49г/моль = 68,6 г
Ответ: m(Н2SO4) = 68,6 г
- 1.1.3. Вычислить массу серной кислоты, необходимую для приготовления 500 мл 0,1 н раствора.
- 1.1.4. Как приготовить:
- а) 1 л 1 н раствора NaOH из твердого NaOH;
- б) 2 л 0,5 н раствора H2SO4 из 100%-ной H2SO4;
- г) 250 мл 0,1 н раствора Al2(SO4)3 из твердого Al2(SO4)3;
- д) 2 л 0,01 н раствора AgNO3 из твердого AgNO3?
Уровень 2
эквивалент реакция химический концентрация
Связь нормальной концентрации с другими способами выражения концентрации растворов
1.2.1. Плотность 15%-ного раствора серной кислоты равна 1,105г/мл. Вычислить нормальность раствора.
Решение:
Пусть m(H2SO4)15%=100г, тогда m(H2SO4)=15г.

мл
г/моль
моль



Ответ: Сн(H2SO4)=3,38н
1.2.2. Какова нормальная концентрация 22%-ного раствора серной кислоты?
Решение:
Пусть mр-ра(H2SO4) = 100 г
Мэкв(H2SO4) =г/моль
Сн(H2SO4) =

Ответ: Сн(H2SO4) =0,45н
- 1.2.3. Как приготовить:
- в) 500 мл 2 н раствора НСl из 36,5%-ного раствора НСl;
- 1.2.4. Определите массовую долю гидроксида натрия в 2 н растворе плотностью 1,08?
- 1.2.5. Определите объем 96%-ной серной кислоты плотностью 1,84 нужно взять для приготовления 1 л 0,5 н раствора?
- 1.2.6. Определите массу медного купороса CuSO4*5H2O надо взять для приготовления 2 л 0,1 н раствора?
- 1.2.7. Перепишите таблицу в тетрадь, заполните пустые места в таблице.
раствор | объем раствора | масса в объеме раствора | количество вещества | молярность раствора | количество вещества эквивалентов | нормальность раствора |
а)серной кислоты Н2SO4 | 1 л | 49 | 0,5 | 0,5 | 1 | 1 |
б)серной кислоты Н2SO4 | 500 мл | 24,5 | ||||
в)серной кислоты Н2SO4 | 2 л | 98 | ||||
г)гидроксида натрия NaOH | 1 л | 1 | ||||
д)гидроксида натрия NaOH | 4 | 0,1 | ||||
е)гидроксида натрия NaOH | 500 мл | 2 | ||||
ж)сернокислого алюминия Al2(SO4)3 | 250 мл | 0,1 |
- 1.2.8. В 1 л воды растворили 1 моль сульфата натрия. Концентрация соли в растворе(с=1,03г/мл) процентная, молярная, нормальная равна:
- 1) 12,43%; 1,25М; 2,50н.
- 2) 15,05%; 0,96М; 1,70н.
- 3) 13,45%; 0,96М; 1,92н.
- 4) 12,43%; 0,95М; 1,80н.
- 1.2.9. В 1 л воды растворили 23,4 г дигидрофосфата кальция. Концентрация соли в полученном растворе, имеющим плотность 1,05 г/мл процентная, молярная, нормальная равна:
- 1) 2,3%; 0,103М; 0,0515н.
- 2) 1,4%; 0,114М; 0,0570н.
- 3) 1,5%; 0,120М; 0,0600н.
- 4) 1,6%; 0,128М; 0,0640н.
Тип 2
Уровень 1
Расчеты по химическим уравнениям, где один из реагентов – раствор с заданной нормальностью
2.1.1. Определить массу карбоната кальция, который выпадает в осадок, если к 400мл 0,5н раствора СаСl2 прибавить избыток раствора соды?
Решение:
nэкв(СаСl2)=Сн*V(СаСl2)= 0,5*0,4 =0,2моль
nэкв(СаСО3)=0,2моль
Мэкв(СаСО3)=f* М (СаСО3) f(СаСО3)=1/2

Мэкв(СаСО3)=г/моль
m(СаСО3)=0,2моль*50г/моль= 10г
Ответ: m(СаСО3)=10г
2.1.2. Определить массу осадка, если к 100 мл 1 н раствора хлорида магния прилить 400 мл 0,5 н раствора нитрата серебра.
Уровень 2
Использование закона эквивалентов
- 2.2.1. Сколько миллилитров 0,1 н раствора серной кислоты пойдет на нейтрализацию:
- а) 10 мл 0,1 н раствора гидроксида натрия;
- б) 25 мл 0,2 н раствора гидроксида калия;
- в) 50 мл 0,01 н раствора гидроксида кальция;
- г) 100 мл 0,2 н раствора гидроксида бария?
- 2.2.2. Сколько 0,5 н раствора гидроксида натрия требуется для нейтрализации:
- а) 100 мл 0,5 н раствора соляной кислоты;
- б) 100 мл 0,5 н раствора серной кислоты;
- в) 100 мл 0,5М раствора серной кислоты;
- г) 100 мл 0,5 н раствора фосфорной кислоты;
- д) 100 мл 0,1 н раствора серной кислоты;
- е) 100 мл 1 н раствора азотной кислоты;
- ж) 10 мл 1 н раствора азотной кислоты;
- з) 10 мл 1М раствора азотной кислоты?
- 2.2.3. Вычислите нормальность раствора серной кислоты, если для титрования:
- а) 10 мл 1 н раствора гидроксида натрия потребовалось 20 мл раствора серной кислоты;
- б) 20 мл 0,1 н раствора гидроксида калия потребовалось 24 мл раствора серной кислоты;
- в) 50 мл 0,5 н раствора гидроксида натрия было израсходовано 40 мл раствора серной кислоты?
- 2.2.4. Какой объем 0,12н раствора гидроксида натрия потребуется для реакции с 40 мл 0,15н раствора серной кислоты? (50мл)
Решение:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Сн(H2SO4) * V(H2SO4) = Сн(NaOH) *V(NaOH) (закон эквивалентов)

Ответ: V(NaOH)=50мл
2.2.5. Для нейтрализации 40мл раствора серной кислоты потребовалось 24мл 0,2н раствора щелочи. Определить нормальность раствора серной кислоты. (0,12н)
Решение:
Сн(H2SO4) * V(H2SO4) = Сн(NaOH) *V(NaOH) (закон эквивалентов)

Ответ: Сн(H2SO4)=0,12н
2.2.6. Какой объем 0,2н раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100мл 0,5н раствора хлорида железа (III)?
Решение:
Сн(FeCl3) * V(FeCl3) = Сн(NaOH) *V(NaOH) (закон эквивалентов)

Ответ: V(NaOH)=250мл
2.2.7. На нейтрализацию 40мл раствора щелочи израсходовано 24мл 0,5н раствора серной кислоты. Какова нормальность раствора щелочи? Какой объем 0,5н раствора соляной кислоты потребовался бы для той
