В каком объеме 3 н раствора содержится 600 г al2 so4 3
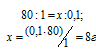
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
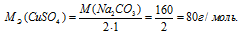
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
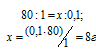
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) – нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) – объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
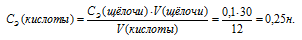
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
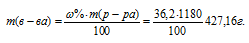
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
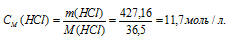
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
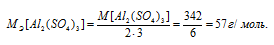
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
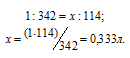
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
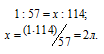
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
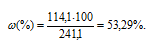
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
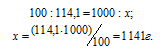
Теперь рассчитаем моляльность раствора:
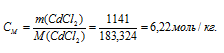
Ответ: 53,3%; 6,22 моль/кг.
Источник
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
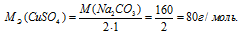
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
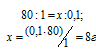
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) – нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) – объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
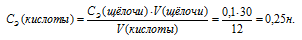
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
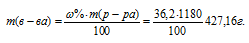
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
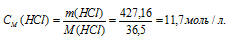
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
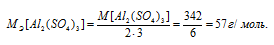
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
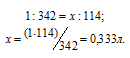
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
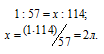
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
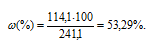
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
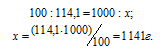
Теперь рассчитаем моляльность раствора:
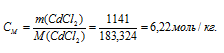
Ответ: 53,3%; 6,22 моль/кг.
Источник

Асия, 3 задание
Посмотрим в стандартную табличку тепловых значений:
CuO + 2HCl = CuCl2 + H2O + 63,6 кДж
Далее составим пропорцию:
80 г. (CuO) – 63,6 кДж
100 г. (CuO) – x кДж => x = 79,5 кДж.
Ответ: Q(CuO) на 100 г. = 79,5 кДж.

Асия, похожая задача.
Сколько мл 50%-ной серной кислоты (р = 1,4 г/см3) необходимо взять для приготовления 500 мл 0,5н.
раствора?
1/найдем массу серной кислоты в 500 мл 0,5 н раствора:
m(H2SO4)=0,5мольэкв/л*0,5л*49г/мольэкв=12,25г
2. Масса кислоты связана с объемом, плотностью и концентрацией исходного раствора соотношением:
m(H2SO4)=VPW, где V- объем раствора мл, Р- плотность раствора, г/см3, w- массовая доля кислоты (в данном случае =0,5)
отсюда V=m(H2SO4)/pW=12,25/(1,4*0,5)=17,5 см3

Асия, 5 номер похожая задача.
На сколько градусов понизится температура замерзания С6Н6, если в 100 г его расстворить 4 г нафталина С10Н8?Криоскопическая константа бензола равна 2,57
Криоскопическая константа бензола К = 5,07 !!!
^t = K*Cm .
М (С10Н8) = 128 г/моль n = 4/128 = 0.031 моль
Cm = 0.031*1000/100 = 0.31 моль/кг – моляльная концентрация раствора .
^t = 5.07*0.31 = 1.572 град
Какой объем 0,1 н. раствора серной кислоты необходимо отмерить для приготовления 100 мл 0,02 н. раствора?
Решение. Т.к. количество молей эквивалентов H2SO4 в исходном и приготовленном растворах одинаково, то, в соответствии с законом эквивалентов (7), объем исходного раствора фото
Какой объем 12%-ного раствора H2SO4 потребуется для приготовления 1 л 0,1н. раствора этой кислоты.
Плотность водного раствора NaCl = 1095,0 г/л. Определить массовую долю соли в растворе, рассчитать молярную долю NaCl, молярную концентрацию, молярную концентрацию эквивалента соли, моляльную концентрацию и массовую концентрацию раствора.
Решение. Для определения массовой доли соли в растворе используем данные табл.3 Приложения. Т.к. заданное значение плотности раствора NaCl в табл.3 отсутствует, применяем метод интерполяции. Для этого используем ближайшие меньшее и большее значения плотностей и соответствующие им массовые доли раствора данной соли. Считая, что в указанных пределах зависимость между плотностью и массовой долей раствора линейная, рассчитаем массовую долю растворенного вещества в растворе по пропорции (индекс б означает “большее”, м – “меньшее”)
Определить процентную концентрацию КОН в растворе, если КОН массой 40 г растворен в воде массой 160 г.
Масса раствора составит m = m(KOH) + m(H2O) = 40 + 160 = 200 г.
ω = 100m(вещество) / m(раствор) = 100*40 / 200 = 20%.
При 0 °С предельная растворимость AgNO3 составляет 22 г. Вычислить процентное содержание AgNO3 в растворе, насыщенном при 0 оС.
Растворимость в данном случае обозначает массу вещества на 100 г. растворителя (вода)
Масса раствора составит 22 + 100 = 122 г.
ω = 100m(вещество) / m(раствор) = 100*22/122 = 18,03%.
. Смешали 300 г 20%-го раствора, и 500 г 40%-го раствора NaCI. Чему равна процентная концентрация полученного раствор?
В 300 г 20%-го раствора содержится (применим обратную формулу) m(вещество) = ω*m(раствор)/100 = 20*300/100 = 60 г. соли.
В 500 г 40%-го раствора содержится m(вещество) = ω*m(раствор)/100 = 40*500/100 = 200 г. соли.
Суммарно соли будет m(вещество) = 60 + 200 = 260 г.
Масса полученного раствора составит, очевидно, m(раствор) = 300 + 500 = 800 г.
Итак,
ω = 100m(вещество) / m(раствор) = 100*260/800 = 32,5%.
Определить процентную концентрацию хлорида натрия в растворе, полученном при растворении соли массой 20 г в воде массой 300 г.
ω = 100m(вещество) / m(раствор) = 100*20/(20 + 300) = 6,25%.
Сколько граммов гидроксида натрия содержится в растворе массой 250 граммов с концентрацией 20%?
m(вещество) = ω*m(раствор)/100 = 20*250/100 = 50 г.
13.1.6 К 300 мл гидроксида калия с концентрацией 20% (плотность 1,2 г/мл) прибавили КОН массой 40 граммов. Определить процентную концентрацию КОН в новом растворе.
Плотность определяется по формуле: ρ = m/V
Отсюда, масса раствора связана с плотностью соотношением: m = ρV
Определим массу 300 мл гидроксида калия с концентрацией 20% с плотностью 1,2 г/мл.
m(раствор) = ρV = 1,2*300 = 360 г.
m(вещество) = ω*m(раствор)/100 = 20*360/100 = 72 г.
После прибавления КОН массой 40 граммов масса вещества станет равной 72 + 40 = 112 г.
Масса раствора станет равной 360 + 40 = 400 г.
ω = 100m(вещество) / m(раствор) = 100*112/400 = 28%.
К 200 мл раствора серной кислоты (пл. 1,066) с концентрацией 10% прилили 1 л воды (пл. 1). Определить процентную концентрацию серной кислоты в новом растворе.
Решение аналогично предыдущему примеру.
Масса раствора кислоты составит 200*1,066 = 213,2 г. с содержанием кислоты 213,2*10/100 = 21,32 г.
Масса раствора составит 213,2 + 1000 = 1213,2 г. (1 л. воды весит 1000 г.)
ω = 100m(вещество) / m(раствор) = 100*21,32/1213,2 = 1,76%.
При упаривании раствора хлорида натрия массой 500 граммов с концентрацией раствора 1% получили новый раствор массой 100 граммов. Какова процентная концентрация полученного раствора?
Поясним, что при упаривании из раствора испаряется вода, количество соли при этом остается неизменным. Поэтому ее концентрация возрастает.
Определим массу соли.
m(вещество) = ω*m(раствор)/100 = 1*500/100 = 5 г.
Масса упаренного раствора задана, 100 г.
ω = 100m(вещество) / m(раствор) = 100*5/100 = 5 %.
Сколько соли надо растворить в воде массой 2 кг, чтобы получить раствор с концентрацией 20%?
Пусть количество соли = х.
Тогда масса раствора составит 2000+х граммов.
Подставим в уравнение ω = 100m(вещество) / m(раствор) наши данные.
20 = 100х/(2000 + х)
х = 500 г.
Сколько воды надо прибавить к раствору массой 3 кг с концентрацией соли 20% для получения 15% раствора?
Пусть масса воды = х.
В растворе содержится 3000*20/100 = 600 г соли.
Масса раствора составит 3000+х граммов.
Подставим в уравнение ω = 100m(вещество) / m(раствор) наши данные.
15 = 100*600/(3000 + х)
х = 1000 г.
Какой объем воды (плотность 1) потребуется для растворения сахара массой 8 граммов, если в приготовленном растворе концентрация должна быть 1%?
Если 1% весит 8 г., то весь раствор весит (пропорция из арифметики для 5 класса):
1% – 8
100% – х
х = 800 г.
Воды в нем будет 800 – 8 = 792 г. При плотности, равной 1, это соответствует объему 792 мл.
Какое количество 10% р-ра соли надо добавить к 200 г. 40% р-ра, чтобы получить 25% раствор?
Чтобы лишний раз не возиться с множителем 100, выразим концентрацию не через процент, а в долях.
10% = 0,1, 40% = 0,4, 25% = 0,25.
Пусть масса искомого раствора = х, тогда масса соли в нем будет 0,1х.
Масса соли во втором растворе составит 200*0,4 = 80 г.
Наконец, масса полученного раствора будет равна х+200. Очевидно, что масса соли в нем будет 0,25(х + 200)
Так же очевидно, что масса соли в третьем растворе равна сумме масс солей в двух исходных.
Тогда,
0,1х + 80 = 0,25(х + 200)
х = 200 г.
Задачи подобного плана на поиск массы добавляемого раствора или определение соотношения смешиваемых растворов решаются по общему уравнению:
ω1m1 + ω2m2 = ω3(m1 + m2)
Сколько граммов 80% и 20%-ной фосфорной кислоты следует взять для приготовления 3000 г 50%-ного раствора?
Пусть х – масса 80%-го раствора, тогда кислоты в нем содержится 0,8х.
Пусть у – масса 20%-го раствора, тогда кислоты в нем содержится 0,2у.
Приготовлено 3000 г раствора, в котором кислоты 3000*0,5 = 1500 г.
Можем составить систему уравнений:
0,8х + 0,2у = 1500
х + у = 3000
Решение системы приводит к ответам:
х = 1500
у = 1500
То есть, надо смешать по 1500 граммов.
Внимание! Для выражения одних концентраций через другие (перерасчета из одних концентраций в другие),
Плотность раствора серной кислоты с концентрацией 1,4 моль/л составляет 1,085 гр/см3. Определите массовую долю H2SO4 в этом растворе.
Возьмем литр раствора.
Масса растворенной кислоты составит
m = C*V*Mr = 1,4*1*98 = 137,2 г.
Масса раствора составит m(p-p) = ρ*V = 1,085*1000 = 1085 г.
ω = 100m/m(p-p) = 100*137,2/1085 = 12,6%.
Источник
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
При обучении школьников способам решения задач
очень большое значение придаю применению
алгоритмов. Я считаю, что вначале нужно уверенно
овладеть небольшим числом стандартных приемов,
получить представление о возможных типах задач.
Это позволит ученику выйти на творческий уровень
в своем дальнейшем химическом образовании и
самообразовании.
Одно из заданий высокого уровня сложности (оно
входит в третью часть экзаменационной
работы – задание С4) проверяет умение
производить расчеты по уравнениям реакций,
происходящих в растворах.
В учебной литературе недостаточно подробно
объясняются особенности решения таких задач.
Поэтому мы с учениками вначале разбираем все
моменты, на которые нужно обратить внимание,
записываем алгоритмы в общем виде, рассматриваем
решение задач каждого типа, затем отрабатываем
умения на самостоятельном решении целого ряда
подобных задач.
Прежде всего ученик должен усвоить понятие о
массовой доле растворенного вещества, или, иначе,
процентной концентрации раствора. Эта величина
показывает отношение массы растворенного
вещества к массе раствора:
р.в-во
= mр.в-во / mр-р.
Производные формулы:
mр.в-во = mр-р•р.в-во,
mр-р = mр.в-во / р.в-во.
Если в условии задачи указан объем раствора с
определенной плотностью, то прежде всего находят
массу раствора:
mр-р = Vр-р•р-р,
затем – массу растворенного вещества:
mр.в-во = mр-р•р.в-во.
Количество вещества находят по массе
растворенного вещества:
= mр.в-во
/ М.
Рассмотрим некоторые типы задач с расчетами по
уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в
растворе после реакции.
При решении таких задач прежде всего нужно
найти количества вещества реагентов. Если задача
на избыток и недостаток, то количества вещества
продуктов реакции находят по веществу, которое
дано в недостатке.
Один из важных моментов – это нахождение
массы раствора после реакции (массы
полученного раствора, mр-р получ). Если
какое-либо вещество взаимодействует с веществом,
находящимся в растворе, то складывают массу
вещества и массу раствора; в случае, когда оба
реагирующих вещества даны в виде растворов,
складывают массы двух растворов. Если в
результате реакции образуется осадок или газ, то
из полученной суммы вычитают массу вещества,
ушедшего из раствора в виде осадка или газа:
mр-р получ = mв-во + mр-р –
mосадок (газ),
mр-р получ = mр-р1 + m
р-р2 – mосадок (газ).
При решении задач на избыток и недостаток нужно
помнить о том, что в растворе после реакции будет
находиться в растворенном виде не только продукт
реакции, но и вещество, которое было дано в
избытке.
Чтобы найти количество вещества, которое не
прореагировало – избытка, нужно от исходного
количества вещества отнять количество
прореагировавшего вещества:
изб
= исх – прор.
Затем найти его массу и массовую долю в
растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл
12%-го раствора серной кислоты ( = 1,05 г/мл). Найти массовую долю
соли в полученном растворе.
| Дано: m(Mg) = 4,8 г, Vр-р(H2SO4) = 200 мл, р-р(H2SO4) р.в-во(H2SO4) | Найти: р.в-во(MgSO4 ). |
Р е ш е н и е
![]()
(Мg) = m / M
= 4,8 (г) / 24 (г/моль) = 0,2 моль.
mр-р(H2SO4) = Vр-р• = 200 (мл)•1,05 (г/мл) = 210
г.
mр.в-во(H2SO4) = mр-р•р.в-во = 210•0,12 =
25,2 г.
р.в-во(H2SO4)
= m/M = 25,2 (г) / 98 (г/моль) = 0,26 моль.
В недостатке – Mg. Следовательно:
(MgSO4) = 0,2
моль,
(H2) = 0,2
моль.
mр.в-во(MgSO4) = M• = 120 (г/моль)•0,2 (моль) = 24 г.
m(H2) = M• = 2 (г/моль)•0,2 (моль) = 0,4 г.
mр-р получ = mр-р(H2SO4)
+ m(Mg) – m(H2) = 210 (г) + 4,8 (г) – 0,4 (г) =
214,4 г.
р.в-во(MgSO4)
= mр.в-во(MgSO4) / mр-р получ =
24 (г) / 214,4 (г) = 0,112, или 11,2 %.
О т в е т. р.в-во(MgSO4) = 11,2 %.
Задача 2. Смешали 250 г раствора сульфата
железа(III) с концентрацией 8 % и 50 г раствора
гидроксида натрия с концентрацией 30 %. Найти
концентрацию веществ в получившемся растворе.
| Дано: mр-р(Fe2(SO4)3) р.в-во(Fe2(SO4)3) mр-р(NaOH) = 50 г, р.в-во(NaOH) | Найти: р.в-во получ. |
Р е ш е н и е
![]()
mр.в-во(Fe2(SO4)3) = mр-р•р.в-во = 250
(г)•0,08 = 20 г.
(Fe2(SO4)3)
= m/M = 20 (г) / 400 (г/моль) = 0,05 моль.
mр.в-во(NaOH) = mр-р•р.в-во = 50 (г)•0,3 = 15 г.
(NaOH) = m/M =
15 (г) / 40 (г/моль) = 0,375 моль.
В недостатке – Fe2(SO4)3.
Следовательно:
(Na2SO4)
= 0,05 (моль)•3 = 0,15 моль.
(Fe(OH)3) = 0,05
(моль)•2 = 0,1 моль.
прор(NaOH) =
0,05 (моль)•6 = 0,3 моль.
изб(NaOH) = исх – прор = 0,375
(моль) – 0,3 (моль) = 0,075 моль.
m(NaOH) = M• =
40 (г/моль)•0,075 (моль) = 3 г.
m(Na2SO4) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
m(Fe(OH)3) = M• = 107 (г/моль)•0,1 (моль) = 10,7 г.
m р-р получ = mр-р(Fe2(SO4)3
+ mр-р(NaOH) – m(Fe(OH)3) = 250 (г) + 50
(г) –10,7 (г) = 289,3 г.
р.в-ва(Na2SO4)
= m / mр-р = 21,3 (г) / 289,3 (г) = 0,074, или 7,4 %.
р.в-ва(NaOH)
= m / mр-р = 3 (г) / 289,3 (г) = 0,01, или 1 %.
О т в е т. р.в-во(Na2SO4) = 7,4 %, р.в-во(NaOH) = 1 %.
Задача 3. Карбонат кальция массой 10 г
растворили при нагревании в 150 мл
хлороводородной кислоты ( = 1,04 г/мл) с массовой долей 9 %.
Какова массовая доля хлороводорода в
получившемся растворе?
О т в е т. р.в-во(HCl) = 4,2 %.
Задача 4. 5,6 г железа растворили в 100 мл 10%-го
раствора соляной кислоты ( = 1,05 г/мл). Вычислить массовую долю
хлороводорода в полученном растворе.
О т в е т. р.в-во(HCl) = 2,9 %.
Задача 5. 5,6 г железа растворили в 200 мл
раствора соляной кислоты ( = 1,05 г/мл) с массовой долей 10 %. Найти
массовую долю соли в полученном растворе.
О т в е т. р.в-во(FeCl2) = 5,9 %.
Задача 6. Смешали 110,4 г раствора карбоната
калия с концентрацией 25 % и 111 г раствора
хлорида кальция с концентрацией 20 %. Найти
концентрацию вещества в полученном растворе.
О т в е т. р.в-во(KCl) = 14,8 %.
Задача 7. Смешали 320 г раствора сульфата
меди(II) с концентрацией 5 % и 120 г раствора
гидроксида натрия с концентрацией 10 %. Найти
концентрации веществ в полученном растворе.
О т в е т. р.в-во(Na2SO4) = 3,3 %, р.в-во(NaOH) = 0,9 %.
• Более сложными являются задачи на
нахождение массы (или объема) вещества, которое
нужно добавить к раствору другого вещества для
того, чтобы его концентрация изменилась в
результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1)нужно обозначить за x количество
добавленного вещества – реагента;
2) выразить через х количества
прореагировавшего с реагентом вещества и
полученного в результате реакции газа или
осадка;
3) найти количество растворенного вещества в
исходном растворе и его количество, оставшееся
после реакции (оставш
= 1 – прор);
4) выразить через х массу оставшегося в
растворе вещества;
5) найти массу раствора, полученного после
реакции:
mр-р получ = mреаг + mр-р1 –
mосадок (газ);
mр-р получ = mр-р1 + mр-р2 –
m осадок (газ).
6) все данные подставить в формулу:
р.в-во2 = mоставш / mр-р получ.
7) найти количество вещества реагента, его массу
или объем.
Задача 8. Найти массу карбоната
кальция, которую следует добавить к 600 г раствора
азотной кислоты с массовой долей 31,5 %, чтобы
массовая доля кислоты уменьшилась до 10,5 %.
| Дано: mр-р1(HNO3) р.в-во1(HNO3) р.в-во2 (HNO3) | Найти: m(CaCO3). |
Р е ш е н и е
![]()
(СаСО3) = х
моль; (HNO3)прор
= 2х моль;
(СО2) = х
моль, m(CO2) = 44x г;
m(CaCO3) = M• = 100 (г/моль)•х (моль) = 100х г;
mр.в-во1(HNO3) = mр-р1•р.в-во1 = 600
(г)•0,315 = 189 г;
1(HNO3)
= m р.в-во /М = 189 (г) / 63 (г/моль) = 3 моль,
оставш(HNO3)
= 1 – прор = 3 – 2х
моль,
mоставш(HNO3) = М• = 63 (г/моль)•(3 – 2х) =
(189 – 126х) г;
mр-р получ = m(CaCO3) + mр-р1(HNO3) –
m(CO2) = 100x + 600 – 44x = 600 + 56x,
р.в-во2(HNO3)
= mоставш(HNO3) / mр-р получ.
0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, (СаСО3)
= 0,955 моль,
m(CaCO3) = M• = 100 (г/моль)•0,955 (моль) = 95,5 г.
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O,
которую необходимо добавить к 47 мл 25%-го раствора
карбоната натрия ( = 1,08 г/мл), чтобы получить раствор, в
котором массовая доля карбоната натрия
составила бы 10 %.
| Дано: Vр-р1(Na2CO3) р-р1(Na2CO3) р.в-во1(Na2CO3) р.в-во2(Na2CO3) | Найти: m(CaCl2•6H2O). |
Р е ш е н и е
![]()
(СaCl2•6H2O)
= x моль, (CaCl2)
= x моль,
прор(Na2CO3)
= х моль, (СаСО3)
= х моль;
m(CaCl2•6H2O) = M• = 219 (г/моль)•х (моль) = 219х г;
m(CaCO3) = M• = 100x г;
mр-р1(Na2CO3) = Vр-р1•р-р1 = 47 (мл)• 1,08
(г/мл) = 50,76 г,
mр.в-во1(Na2CO3) = mр-р1• р.в-во1 = 50,76
(г)•0,25 = 12,69 г,
1(Na2CO3)
= mр.в-во1 / M = 12,69 (г) / 106 (г/моль) = 0,12
моль,
оставш(Na2CO3)
= 1 – прор = 0,12 – х,
mоставш(Na2CO3) = M• = 106(0,12 – x) =
12,69 – 106x;
mр-р получ = m(CaCl2•6H2O) + mр-р1(Na2CO3) –
m(CaCO3),
219x + 50,76 – 100x = 50,76 + 119x,
р.в-во2 = mоставш(Na2CO3)
/ mр-р получ,
0,1 = 12,69 – 106х / 50,76 + 119х,
х = 0,0646 моль.
m(CaCl2•6H2O) = М• = 219 (г/моль)•0,0646 (моль) = 14,14 г.
О т в е т. m(CaCl2•6H2O) = 14,4 г.
Задача 10. Какой объем 30%-го раствора
аммиака ( = 0,892
г/мл) необходимо добавить к 200 мл 40%-го раствора
соляной кислоты ( = 1,198 г/мл), чтобы массовая доля
кислоты уменьшилась вчетверо?
О т в е т. Vр-р(NH3) = 108,2 мл.
Задача 11. Какой объем углекислого газа
нужно добавить к 100 мл 20%-го раствора гидроксида
натрия ( = 4,1
г/мл), чтобы массовая доля гидроксида натрия
уменьшилась вдвое?
О т в е т. V(CO2) = 10,9 л.
Задача 12. Найти объем раствора соляной
кислоты ( = 1,05
г/мл) с массовой долей 10 %, который нужно
добавить к 350 г раствора гидроксида калия с
массовой долей 10,5 %, чтобы концентрация щелочи
составила 3 %.
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество –
реагент!
При решении задач на растворы нужно помнить о
том, что при обычных условиях с водой реагируют
следующие вещества:
1) щелочные и щелочно-земельные металлы,
например:
2Na + 2H2O = 2NaOH + H2;
2) оксиды щелочных и щелочно-земельных металлов,
например:
СаО + Н2О = Са(ОН)2;
3) оксиды неметаллов, например:
SO3 + H2O = H2SO4;
4) многие бинарные соединения – гидриды,
карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2.
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет
продукт взаимодействия вещества-реагента с
водой. Масса раствора будет складываться из
массы реагента и массы воды:
mр-р = mреаг + mH2O.
Если в результате реакции выделился газ, то
mр-р = mреаг + mH2O –
mгаз.
Задача 13. В каком объеме воды нужно
растворить 11,2 л оксида серы(IV), чтобы получить
раствор сернистой кислоты с массовой долей 1 %?
| Дано: V(SO2) = 11,2 л, р.в-во(H2SO3) | Найти: V(H2O). |
Р е ш е н и е
![]()
(SO2) = V / VM
= 11,2 (л) / 22,4 (л/моль) = 0,5 моль, следовательно, (H2SO3) = 0,5
моль.
mр.в-во(H2SO3) = M• = 82 (г/моль)•0,5 (моль) =
41 г,
mр-р(H2SO3) = mр.в-во(H2SO3)
/ р.в-во(H2SO3)
= 41 (г) / 0,01 = 4100 г;
m(H2O) = mр-р(H2SO3) –
m(SO2),
m(SO2) = M• = 64 (г/моль)•0,5 (моль) = 32 г,
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ = 4068 (г) / 1 (г/мл) = 4068 мл, или 4 л 68 мл.
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса
вещества-реагента, необходимого для образования
раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за
х моль;
2) согласно уравнению реакции выразить через х
количества продуктов реакции;
3) найти через х массы реагента и продуктов
реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета
массовой доли вещества в растворе:
р.в-во(продукт)
= mр.в-во(продукт) / mр-р.
Задача 14. Найти массу гидрида лития,
которую нужно растворить в 100 мл воды, чтобы
получить раствор с массовой долей гидроксида
лития 5 %.
| Дано: V(H2O) = 100 мл, р.в-во(LiOH) | Найти: m(LiH). |
Р е ш е н и е
![]()
Пусть (LiH) = x
моль,
тогда (LiOH) = x
моль, (Н2) = х
моль.
m(LiH) = M•
= 8 (г/моль)•х (моль) = 8х (г),
m(LiOH) = M•
= 24 (г/моль)•х (моль) = 24х г,
m(H2) = M• = 2 (г/моль)•х = 2х г.
mр-р = m(LiH) + m(H2O) – m(H2),
m(H2O) = V• = 100 (мл)•1 (г/мл) = 100 г.
mр-р = 8х + 100 – 2х = 6х + 100.
р.в-во(LiOH)
= mр.в-во(LiOH) / mр-р,
0,05 = 24х / (6х + 100); 0,3х + 5 = 24х,
х = 0,21, (LiH) =
0,21 моль.
m(LiH) = M•
= 8 (г/моль)•0,21 (моль) = 1,7 г.
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует
с водой, которая присутствует в растворе. Масса
растворенного вещества во втором растворе
складывается из массы вещества в первом растворе
и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•р.в-во1,
mр.в-во2 = mр.в-во1• mр.в-во(прод.),
mр-р2 = mр-р1 + mреаг,
или mр-р2 = mр-р1 + mреаг –
mгаз.
р.в-во2
= mр.в-во2 / mр-р2.
Задача 15. К 200 г 10%-го раствора
ортофосфорной кислоты добавили 28,4 г фосфорного
ангидрида. Найти массовую долю кислоты в
получившемся растворе.
| Дано: mр-р1(H3PO4) р.в-во1(Н3РО4) m(P2O5) = 28,4 г. | Найти: р.в-во2(Н3РО4). |
Р е ш е н и е
![]()
(P2O5) =
m / M = 28,4 (г) / 142 (г/моль) = 0,2 моль,
прод(Н3РО4)
= 0,2 (моль)•2 = 0,4 моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•0,4 (моль) =
39,2 г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 200 (г)
•0,1 = 20 г,
mр.в-во2(Н3РО4) = mр.в-во2(Н3РО4)
+ mпрод(Н3РО4) = 20 (г) + 39,2 (г) = 59,2
г;
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 200 (г) + 28,4 (г) = 228,4
г.
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4)
= 59,2 (г) / 228,4 (г) = 0,2592, или 25,92 %.
О т в е т: (Н3РО4) = 25,92 %.
Задача 16. Найти массу фосфорного
ангидрида, которую необходимо добавить к 70 г 10%-го
раствора ортофосфорной кислоты, чтобы получить
40%-й раствор.
| Дано: mр-р1(Н3РО4) р.в-во1(Н3РО4) р.в-во2(Н3РО4) | Найти: m(P2O5). |
Р е ш е н и е
![]()
Пусть (Р2О5)
= х моль,
тогда (Н3РО4)
= 2х моль.
mпрод(Н3РО4) = М• = 98 (г/моль)•2х
(моль) = 196х г.
mреаг(Р2О5) = М• = 142 (г/моль)•х
(моль) = 142х г,
mр.в-во1(Н3РО4) = mр-р1•р.в-во1 = 70 (г)•
0,1 = 7 г,
mр.в-во2(Н3РО4) = mр.в-во1(Н3РО4)
+ mпрод(Н3РО4) = 7 + 196х, 000000
mр-р2(Н3РО4) = mр-р1(Н3РО4)
+ mреаг(Р2О5) = 70 + 142х,
р.в-во2(Н3РО4)
= mр.в-во2(Н3РО4) / mр-р2(Н3РО4),
0,4 = (7 + 196х) / (70 + 142х),
х = 0,15, (Р2О5)
= 0,15 моль.
m(P2O5) = M• = 142 (г/моль)•0,15 (моль) = 21,3 г.
О т в е т. m(P2O5) = 21,3 г.
Задача 17. В 240 мл воды опустили 69 г натрия.
Найти массовую долю продукта в растворе.
О т в е т. прод = 39,2 %.
Задача 18. Найти массовую долю кислоты в
растворе, полученном при растворении 33,6 л
сернистого газа в 320 г 5%-го раствора сернистой
кислоты.
О т в е т. р.в-во2(Н2SО3) = 33,4 %.
Задача 19. Какую массу оксида серы(VI) нужно
растворить в 150 мл воды, чтобы получить 60%-й
раствор серной кислоты?
О т в е т. m(SO3) = 144 г.
Задача 20. Найти массу оксида серы(VI),
которую необходимо растворить в 99 г 40%-й серной
кислоты, чтобы получить 80%-й раствор.
О т в е т. m(SO3) = 93 г.
Задача 21. Какую массу оксида фосфора(V)
нужно растворить в 120 г воды, чтобы получить 40%-й
раствор ортофосфорной кислоты?
О т в е т. m(P2O5) = 49 г.
Задача 22. К 180 г 50%-го раствора
ортофосфорной кислоты добавили 42,6 г оксида
фосфора(V). Найти массовую долю кислоты в
полученном растворе.
О т в е т. р.в-во2(Н3РО4) = 66,8 %.
Задача 23. В 20 г воды растворили 3,5 г оксида
натрия. Вычислите массо
