В каком объеме раствора указанной концентрации содержится
Êîíöåíòðàöèÿ ðàñòâîðà ìîæåò âûðàæàòüñÿ êàê â áåçðàçìåðíûõ åäèíèöàõ (äîëÿõ, ïðîöåíòàõ), òàê è â ðàçìåðíûõ âåëè÷èíàõ (ìàññîâûõ äîëÿõ, ìîëÿðíîñòè, òèòðàõ, ìîëüíûõ äîëÿõ).
Êîíöåíòðàöèÿ – ýòî êîëè÷åñòâåííûé ñîñòàâ ðàñòâîðåííîãî âåùåñòâà (â êîíêðåòíûõ åäèíèöàõ) â åäèíèöå îáúåìà èëè ìàññû. Îáîçíà÷èëè ðàñòâîðåííîå âåùåñòâî – Õ, à ðàñòâîðèòåëü – S. ×àùå âñåãî èñïîëüçóþ ïîíÿòèå ìîëÿðíîñòè (ìîëÿðíàÿ êîíöåíòðàöèÿ) è ìîëüíîé äîëè.
Ñïîñîáû âûðàæåíèÿ êîíöåíòðàöèè ðàñòâîðîâ.
1. Ìàññîâàÿ äîëÿ (èëè ïðîöåíòíàÿ êîíöåíòðàöèÿ âåùåñòâà) – ýòî îòíîøåíèå ìàññû ðàñòâîðåííîãî âåùåñòâà m ê îáùåé ìàññå ðàñòâîðà. Äëÿ áèíàðíîãî ðàñòâîðà, ñîñòîÿùåãî èç ðàñòâîð¸ííîãî âåùåñòâà è ðàñòâîðèòåëÿ:
 ,
,
ãäå:
ω – ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà;
mâ-âà – ìàññà ðàñòâîð¸ííîãî âåùåñòâà;
mð-ðà – ìàññà ðàñòâîðèòåëÿ.
Ìàññîâóþ äîëþ âûðàæàþò â äîëÿõ îò åäèíèöû èëè â ïðîöåíòàõ.
2. Ìîëÿðíàÿ êîíöåíòðàöèÿ èëè ìîëÿðíîñòü – ýòî êîëè÷åñòâî ìîëåé ðàñòâîð¸ííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà V:
 ,
,
ãäå:
C – ìîëÿðíàÿ êîíöåíòðàöèÿ ðàñòâîð¸ííîãî âåùåñòâà, ìîëü/ë (âîçìîæíî òàêæå îáîçíà÷åíèå Ì, íàïðèìåð, 0,2 Ì HCl);
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
V – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîð íàçûâàþò ìîëÿðíûì èëè îäíîìîëÿðíûì, åñëè â 1 ëèòðå ðàñòâîðà ðàñòâîðåíî 1 ìîëü âåùåñòâà, äåöèìîëÿðíûì – ðàñòâîðåíî 0,1 ìîëÿ âåùåñòâà, ñàíòèìîëÿðíûì – ðàñòâîðåíî 0,01 ìîëÿ âåùåñòâà, ìèëëèìîëÿðíûì – ðàñòâîðåíî 0,001 ìîëÿ âåùåñòâà.
3. Ìîëÿëüíàÿ êîíöåíòðàöèÿ (ìîëÿëüíîñòü) ðàñòâîðà Ñ(x) ïîêàçûâàåò êîëè÷åñòâî ìîëåé n ðàñòâîðåííîãî âåùåñòâà â 1 êã ðàñòâîðèòåëÿ m:
 ,
,
ãäå:
Ñ (x) – ìîëÿëüíîñòü, ìîëü/êã;
n – êîëè÷åñòâî ðàñòâîðåííîãî âåùåñòâà, ìîëü;
mð-ëÿ – ìàññà ðàñòâîðèòåëÿ, êã.
4. Òèòð – ñîäåðæàíèå âåùåñòâà â ãðàììàõ â 1 ìë ðàñòâîðà:
 ,
,
ãäå:
T – òèòð ðàñòâîð¸ííîãî âåùåñòâà, ã/ìë;
mâ-âà – ìàññà ðàñòâîðåííîãî âåùåñòâà, ã;
Vð-ðà – îáú¸ì ðàñòâîðà, ìë.
5. Ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà – áåçðàçìåðíàÿ âåëè÷èíà, ðàâíàÿ îòíîøåíèþ êîëè÷åñòâà ðàñòâîðåííîãî âåùåñòâà n ê îáùåìó êîëè÷åñòâó âåùåñòâ â ðàñòâîðå:
 ,
,
ãäå:
N – ìîëüíàÿ äîëÿ ðàñòâîð¸ííîãî âåùåñòâà;
n – êîëè÷åñòâî ðàñòâîð¸ííîãî âåùåñòâà, ìîëü;
nð-ëÿ – êîëè÷åñòâî âåùåñòâà ðàñòâîðèòåëÿ, ìîëü.
Ñóììà ìîëüíûõ äîëåé äîëæíà ðàâíÿòüñÿ 1:
N(X) + N(S) = 1.
ãäå N(X) – ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà Õ;
N(S) – ìîëüíàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà S.
Èíîãäà ïðè ðåøåíèè çàäà÷ íåîáõîäèìî ïåðåõîäèòü îò îäíèõ åäèíèö âûðàæåíèÿ ê äðóãèì:

ω(X) – ìàññîâàÿ äîëÿ ðàñòâîðåííîãî âåùåñòâà, â %;
Ì(Õ) – ìîëÿðíàÿ ìàññà ðàñòâîðåííîãî âåùåñòâà;
ρ= m/(1000V) – ïëîòíîñòü ðàñòâîðà.6. Íîðìàëüíàÿ êîíöåíòðàöèÿ ðàñòâîðîâ (íîðìàëüíîñòü èëè ìîëÿðíàÿ êîíöåíòðàöèÿ ýêâèâàëåíòà) – ÷èñëî ãðàìì-ýêâèâàëåíòîâ äàííîãî âåùåñòâà â îäíîì ëèòðå ðàñòâîðà.
Ãðàìì-ýêâèâàëåíò âåùåñòâà – êîëè÷åñòâî ãðàììîâ âåùåñòâà, ÷èñëåííî ðàâíîå åãî ýêâèâàëåíòó.
Ýêâèâàëåíò – ýòî óñëîâíàÿ åäèíèöà, ðàâíîöåííàÿ îäíîìó èîíó âîäîðîäà â êèñëîòîíî-îñíîâíûõ ðåàêöèÿõ èëè îäíîìó ýëåêòðîíó â îêèñëèòåëüíî – âîññòàíîâèòåëüíûõ ðåàêöèÿõ.
Äëÿ çàïèñè êîíöåíòðàöèè òàêèõ ðàñòâîðîâ èñïîëüçóþò ñîêðàùåíèÿ í èëè N. Íàïðèìåð, ðàñòâîð, ñîäåðæàùèé 0,1 ìîëü-ýêâ/ë, íàçûâàþò äåöèíîðìàëüíûì è çàïèñûâàþò êàê 0,1 í.
 ,
,
ãäå:
ÑÍ – íîðìàëüíàÿ êîíöåíòðàöèÿ, ìîëü-ýêâ/ë;
z – ÷èñëî ýêâèâàëåíòíîñòè;
Vð-ðà – îáú¸ì ðàñòâîðà, ë.
Ðàñòâîðèìîñòü âåùåñòâà S – ìàêñèìàëüíàÿ ìàññà âåùåñòâà, êîòîðàÿ ìîæåò ðàñòâîðèòüñÿ â 100 ã ðàñòâîðèòåëÿ:

Êîýôôèöèåíò ðàñòâîðèìîñòè – îòíîøåíèå ìàññû âåùåñòâà, îáðàçóþùåãî íàñûùåííûé ðàñòâîð ïðè êîíêðåòíîé òåìïåðàòóðå, ê ìàññå ðàñòâîðèòåëÿ:

Источник
Задача 416.
В каком объеме 0,1н. раствора содержится 8г CuSO4?
Решение:
Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
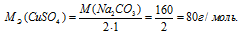
Массу 0,1 эквивалента соли CuSO4 находим из пропорции:
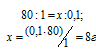
8г CuSO4 соответствует 0,1 эквиваленту, значит, эта масс содержится в 1л раствора.
Ответ: 1л.
Задача 417.
Для нейтрализации 30мл 0,1н. раствора щелочи потребовалось 12мл раствора кислоты. Определить нормальность кислоты.
Решение:
Для определения нормальности кислоты используем математическое выражение следствия из закона эквивалентности (так называемое правило пропорциональности):
CЭ(А) .V(A) = CЭ(B) . V(B),
CЭ(А) и CЭ(B) – нормальные концентрации эквивалентов веществ А и В, моль/л; V(A) и V(B) – объёмы растворов веществ А и В.
По условию задачи известны CЭ(щелочи), V(щелочи) и V(кислоты), то нетрудно вычислить СЭ(кислоты) по формуле:
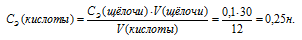
Ответ: 0,25н.
Задача 418.
Найти молярность 36,2%-ного (по массе) раствора НСI, плотность которого 1,18г/мл.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Масса 1 литра раствора HCl (р = 1,18г/мл) равна 1180г (1000 . 1,18 = 1180).
Массу HCl, содержащуюся в 1 литре раствора рассчитаем по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
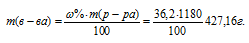
Молярную концентрацию раствора (СМ) получим делением числа граммов HCl в 1л раствора на молярную массу HCl (36,5г/моль):
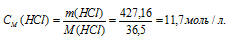
Ответ: 11,7 моль/л.
Задача 419.
В каком объеме 1М раствора и в каком объеме 1н. раствора содержится 114г Al2(SО4)3?
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащихся в 1 литре раствора.
M[Al2(SО4)3] = 342 г/моль. Эквивалентная масса соли равна молекулярной массе данной соли делённой на общую валентность металла, входящего в состав соли:

где
MЭ(В) – молярная масса эквивалента соли, г/моль; М(В) – молярная масса соли; n – коэффициент при атоме металла; A – валентность металла.
Отсюда
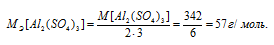
Находим, в каком объёме 1М раствора содержится 114г Al2(SО4)3 из пропорции:
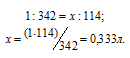
Теперь находим объём 1н раствора, в котором содержится 114г Al2(SО4)3, составив про-порцию:
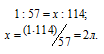
Ответ: 0,333л; 2л.
Задача 420.
Растворимость хлорида кадмия при 20°С равна 114,1г в 100г воды. Вычислить массовую долю и моляльность CdCl2 в насыщенном растворе.
Решение:
M(CdCl2) = 183,324г/моль.
Растворимость вещества измеряется содержанием вещества в его насыщенном растворе. Обычно растворимость твёрдых веществ и жидкостей выражают значением коэффициента растворимости, т.е. массой вещества, растворяющегося при данных условиях в 100 г воды или другого растворителя с образованием насыщенного раствора.
m(CdCl2) = 114,1г. m(р-ра) = m(CdCl2) + m(H2O) = 114,1 + 100 = 241,1г.
Массовую долю CdCl2 вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда
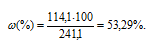
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов CdCl2 содержится в 1000г воды, составив пропорцию:
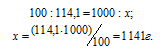
Теперь рассчитаем моляльность раствора:
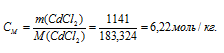
Ответ: 53,3%; 6,22 моль/кг.
Источник
Изучите материал!
Процентная концентрация раствора
С% = W% (растворённого вещества) = (m растворённого вещества• 100%) /m раствора
m1/m2 = (W3-W2)/(W1-W3) |
Молярная концентрация раствора
1. Молярную концентрацию (Cm) растворов определяют по формуле: Cm = υрастворённого вещества/ Vраствора где ν = m/M – количество вещества (здесь М – молярная масса вещества), V – объём 2. Cm измеряют в моль/л или моль/м3 (в системе СИ). 3. Молярная концентрация показывает количество растворённого вещества (моль), содержащегося в 1 л раствора. |
РЕШИТЕ ЗАДАЧИ!
Задачи по теме: Массовая доля растворенного вещества.
I уровень
1. Вычислите массовую долю растворенного вещества, если в 150 г. воды растворили 7 г. соли.
( Ответ: 4,46 %)
2. В 80 мл. воды растворили 6 г. глюкозы. Рассчитайте массовую долю глюкозы в полученном растворе.
( Ответ: 6,98 %)
3. Какую массу сахара нужно взять и какой объем воды, чтобы приготовить раствор массой 240 г. с массовой долей сахара 6%.
( Ответ: 14,4 г. сахара; 225,6 мл. воды)
4. Вычислите массы соли и воды, необходимые для приготовления
300 г. раствора с массовой долей соли 15 %.
( Ответ: 45 г. соли; 255 г. воды)
5. Выпарили 150 г. раствора с массовой долей сахара 15 %. Вычислите массу сахара, оставшегося в чашке после выпаривания воды.
( Ответ: 22,5 г.)
II уровень.
6. Сколько граммов сульфата меди необходимо смешать с 450 г. воды, чтобы получить раствор с массовой долей 10 %.
( Ответ: 50 г.)
7. В каком количестве воды нужно растворить 40 г. соли для получения раствора с массовой долей 25 %.
( Ответ: 120 г.)
8. Смешали 150 г. раствора с массовой долей серной кислоты 10 % и 250 г. раствора с массовой долей серной кислоты 8 %. Определите массовую долю кислоты в полученной смеси.
( Ответ: 8,75 %)
9. 120 г. раствора с массовой долей соли 10 % упарили до 80 г. Какова массовая доля (в %) соли в упаренном растворе?
( Ответ: 15 %)
10. Определите массовую долю серной кислоты в растворе, если к 600 г. раствора с массовой долей 12 % добавили ещё 200 мл. воды.
( Ответ: 9 %)
III уровень.
11. Определите массу соли, которую нужно добавить к 80 г. раствора с массовой долей соли 10 %, чтобы получить раствор с массовой долей этой соли 25 %.
( Ответ: 16 г.)
12. Определите массу воды, которую нужно добавить к 50 г. раствора с массовой долей соли 5 %, чтобы получить раствор с массовой долей соли 2 %.
( Ответ: 75 г.)
13. Необходимо приготовить 500 г. раствора серной кислоты, массовая доля которой 0,3. Вычислите массу 98 %-го раствора серной кислоты, которая потребуется для приготовления такого раствора.
( Ответ: 153,06 г.)
14. В 130 мл. воды растворили 35,8 г. ZnSO4. 7 H20. Рассчитайте массовую долю растворенного вещества.
( Ответ: 12,11 %)
15. Какой объем газа HI (н.у.) нужно растворить в воде, чтобы получить 40 г. раствора HI с массовой долей 20 %.
( Ответ: 1,41 л.)
Задачи по теме: «Молярная концентрация раствора»
1. Вычислите массу хлорида натрия, необходимого для приготовления 200мл раствора, в котором концентрация нитрата калия равна 0,5моль/л.
2. Вычислите объём раствора с молярной концентрацией 2,5моль/л, содержащего 6 моль хлорида натрия.
3. Вычислите молярную концентрацию раствора поваренной соли, если в 1 л этого раствора содержится 25 моль хлорида натрия.
4. Вычислите молярную массу вещества, если известно, что в 36 л раствора с молярной концентрацией 9 моль/л было растворено 1440 г вещества.
ТИПЫ ЗАДАЧ ПО ТЕМЕ: “РАСТВОРЫ”
Источник
В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Решение задач на разбавление растворов особой
сложности не представляет, однако требует
внимательности и некоторого напряжения. Тем не
менее можно упростить решение этих задач,
используя закон разбавления, которым пользуются
в аналитической химии при титровании растворов.
Во всех задачниках по химии показаны решения
задач, представленных как образец решения, и во
всех решениях используется закон разбавления,
принцип которого состоит в том, что количество
растворенного вещества и масса m в исходном и разбавленном
растворах остаются неизменными. Когда мы решаем
задачу, то это условие держим в уме, а расчет
записываем по частям и постепенно, шаг за шагом,
приближаемся к конечному результату.
Рассмотрим проблему решения задач на
разбавление, исходя из следующих соображений.
• Количество растворенного вещества :
= c•V,
где c – молярная концентрация
растворенного вещества в моль/л, V – объем
раствора в л.
• Масса растворенного вещества m(р.в.):
m(р. в.) = m(р-ра)•,
где m(р-ра) – масса раствора в г, – массовая доля
растворенного вещества.
Обозначим в исходном (или неразбавленном)
растворе величины c, V, m(р-ра), через с1, V1,
m1(р-ра), 1,
а в разбавленном растворе – через с2, V2,
m2(р-ра), 2.
Составим уравнения разбавления растворов. Левые
части уравнений отведем для исходных
(неразбавленных) растворов, а правые части – для
разбавленных растворов.
Неизменность количества растворенного вещества
при разбавлении будет иметь вид:
![]()
Сохранение массы m(р. в.):
![]()
Количество растворенного вещества связано с его массой m
(р. в.) cоотношением:
= m(р.
в.)/M(р. в.),
где M(р. в.) – молярная масса растворенного
вещества в г/моль.
Уравнения разбавления (1) и (2) связаны между собой
следующим образом:
с1•V1 = m2(р-ра)•2/M(р. в.),
m1(р-ра)•1 = с2•V2•M(р.
в.).
Если в задаче известен объем растворенного
газа V(газа), то его количество вещества связано с объемом
газа (н.у.) отношением:
= V(газа)/22,4.
Уравнения разбавления примут соответственно
вид:
V(газа)/22,4 = с2•V2,
V(газа)/22,4 = m2(р-ра)•2/M(газа).
Если в задаче известны масса вещества или
количество вещества, взятого для приготовления
раствора, то в левой части уравнения разбавления
ставится m(р. в.) или , в зависимости от условия задачи.
Если по условию задачи требуется объединить
растворы разной концентрации одного и того же
вещества, то в левой части уравнения массы
растворенных веществ суммируются.
Довольно часто в задачах используется плотность
раствора (г/мл). Но
поскольку молярная концентрация с
измеряется в моль/л, то и плотность следует
выражать в г/л, а объем V – в л.
Приведем примеры решения «образцовых» задач.
Задача 1. Какой
объем 1М раствора серной кислоты надо взять,
чтобы получить 0,5 л 0,1М H2SO4?
Дано:
с1 = 1 моль/л,
V2 = 0,5 л,
с2 = 0,1 моль/л.
Найти:
V1 = ?
Решение
V1•с1 = V2•с2,
V1•1 = 0,5•0,1; V1 = 0,05 л,
или 50 мл.
Ответ. V1 = 50 мл.
Задача 2 ([1],
№ 4.23). Определите массу раствора с массовой
долей (СuSО4)
10% и массу воды, которые потребуются для
приготовления раствора массой 500 г с массовой
долей
(СuSО4) 2%.
Дано:
1 = 0,1,
m2(р-ра) = 500 г,
2 = 0,02.
Найти:
m1(р-ра) = ?
m(H2O) = ?
Решение
m1(р-ра)•1 = m2(р-ра)•2,
m1(р-ра)•0,1 = 500•0,02.
Отсюда m1(р-ра) = 100 г.
Найдем массу добавляемой воды:
m(H2O) = m2(р-ра) – m1(р-ра),
m(H2O) = 500 – 100 = 400 г.
Ответ. m1(р-ра) = 100 г, m(H2O)
= 400 г.
Задача 3 ([1],
№ 4.37). Какой объем раствора с массовой долей
серной кислоты 9,3%
( = 1,05 г/мл)
потребуется для приготовления 0,35М раствора H2SO4объемом 40 мл?
Дано:
1 = 0,093,
1 = 1050 г/л,
с2 = 0,35 моль/л,
V2 = 0,04 л,
М(H2SO4) = 98 г/моль.
Найти:
V1 = ?
Решение
m1(р-ра)•1 = V2•с2•М(H2SO4),
V1•1•1
= V2• с2•М(H2SO4).
Подставляем значения известных величин:
V1•1050•0,093 = 0,04•0,35•98.
Отсюда V1 = 0,01405 л, или 14,05 мл.
Ответ. V1 = 14,05 мл.
Задача 4 [2]. Какой
объем хлороводорода (н.у.) и воды потребуется,
чтобы приготовить 1 л раствора ( = 1,05 г/см3), в котором
содержание хлороводорода в массовых долях равно
0,1
(или 10%)?
Дано:
V(р-ра) = 1 л,
(р-ра) = 1050 г/л,
= 0,1,
М(HCl) = 36,5 г/моль.
Найти:
V(HCl) = ?
m(H2O) = ?
Решение
V(HCl)/22,4 = m(р-ра)•/М(HCl),
V(HCl)/22,4 = V(р-ра)•(р-ра)•/М(HCl),
V(HCl)/22,4 = 1•1050•0,1/36,5.
Отсюда V(HCl) = 64,44 л.
Найдем массу добавляемой воды:
m(H2O) = m(р-ра) – m(HСl),
m(H2O) = V(р-ра)•(р-ра) – V(HCl)/22,4• М(HCl),
m(H2O) = 1•1050 – 64,44/22,4•36,5 = 945 г.
Ответ. 64,44 л HCl и 945 г воды.
Задача 5 ([1],
№ 4.34). Определите молярную концентрацию
раствора с массовой долей гидроксида натрия 0,2 и
плотностью 1,22 г/мл.
Дано:
= 0,2,
= 1220 г/л,
М(NaOH) = 40 г/моль.
Найти:
c = ?
Решение
m(р-ра)• = с•V•М(NaOH),
m(р-ра)• = с•m(р-ра)•М(NaOH)/.
Разделим обе части уравнения на m(р-ра) и
подставим численные значения величин.
0,2 = c•40/1220.
Отсюда c = 6,1 моль/л.
Ответ. c = 6,1 моль/л.
Задача 6 ([1],
№ 4.30). Определите молярную концентрацию
раствора, полученного при растворении сульфата
натрия массой 42,6 г в воде массой 300 г, если
плотность полученного раствора равна 1,12 г/мл.
Дано:
m(Na2SO4) = 42,6 г,
m(H2O) = 300 г,
= 1120 г/л,
M(Na2SO4) = 142 г/моль.
Найти:
c = ?
Решение
m(Na2SO4) = с•V•М(Na2SO4).
Подставляя численные значения, получим:
42,6 = с•(42,6 + 300)/1120•142.
Отсюда с = 0,98 моль/л.
Ответ. с = 0,98 моль/л.
Задача 7 ([1],
№ 4.19). В лаборатории имеются растворы с
массовой долей хлорида натрия 10% и 20%. Какую массу
каждого раствора надо взять для получения
раствора с массовой долей соли 12% и массой 300 г?
Дано:
1 = 0,1,
2 = 0,2,
3 = 0,12,
m3(р-ра) = 300 г.
Найти:
m1(р-ра) = ?
m2(р-ра) = ?
Решение
m1(р-ра)•1 + m2(р-ра)•2 = m3(р-ра)•3,
m1(р-ра)•0,1 + m2(р-ра)•0,2
= 300•0,12.
Поскольку m1(р-ра) + m2(р-ра) = 300
г, то получаем систему из двух уравнений с двумя
неизвестными. Решая совместно два уравнения,
находим:
m1(р-ра) = 240 г, m2(р-ра) =
60 г.
Ответ. m1(р-ра) = 240 г, m2(р-ра)
= 60 г.
Задача 8 ([1],
№ 4.48). В воде массой 100 г при температуре 0 °С
растворяется фторид натрия массой 4,1 г, а при
температуре 40 °С – массой 4,5 г. Какая масса
фторида натрия выпадет в осадок при охлаждении
насыщенного при температуре 40 °С раствора NaF
массой 500 г до температуры 0 °С?
Дано:
m1(NaF) = 4,1 г,
m2(NaF) = 4,5 г,
m2(р-ра) = 500 г,
– массовая доля
NaF,
(1 – ) – массовая
доля воды.
Найти:
m(NaF) = ?
Решение
m(NaF) = m2(р-ра) – m1(р-ра).
Поскольку m2(Н2О) (40 °С) = m1(Н2О)
(0 °С), то можно записать:
m2(р-ра)•(1 – 2) = m1(р-ра)•(1 – 1).
Подставляем значения:
500•(1 – 4,5/(4,5 + 100)) = m1(р-ра)•(1 –
4,1/(4,1 + 100)).
Отсюда m1(р-ра) = 104,1/104,5•500 = 498,09 г,
m(NaF) = 500 – 498,09 = 1,91 г.
Ответ. m(NaF) = 1,91 г.
ЛИТЕРАТУРА
1. Хомченко Г.П., Хомченко И.Г. Задачи по химии
для поступающих в вузы. М.: Новая волна, 2002.
2. Фельдман Ф.Г., Рудзитис Г.Е. Химия-9. М.:
Просвещение, 1990, с. 166.
В.И.МАРТЫНОВ,
учитель химии
(пос. Архипо-Осиповка, Краснодарский край)
Источник
Массовая доля растворённого вещества
это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора:
$omega_text{в-ва}=dfrac{m_text{в-ва}}{m_text{р-ра}}(cdot 100%)$
Подробнее см. тему “Массовая доля элемента. Массовая доля вещества”.
ОБЪЕМНАЯ ДОЛЯ (ДЛЯ ГАЗОВ)
Для характеристики газовой смеси используют похожую величину – объемную долю. Объемная доля равна отношению объема газа к общему объему газовой смеси. Выражается в % или является безразмерной величиной:
$varphi textrm{(газа)} = dfrac{Vtextrm{(газа)} }{Vtextrm{(смеси)} } (cdot 100%)$
Самым распространенным примером газовой смеси можно смело назвать воздух. Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие.
Рассчитаем объемную долю каждого газа:
 $varphi (N_2)= dfrac{V(N_2)} {Vtextrm{(смеси)} } =dfrac{78textrm{л}}{100textrm{л}}=0,78=78%$
$varphi (N_2)= dfrac{V(N_2)} {Vtextrm{(смеси)} } =dfrac{78textrm{л}}{100textrm{л}}=0,78=78%$
$varphi (O_2)= dfrac{V(O_2)} {Vtextrm{(смеси)} } =dfrac{21textrm{л}}{100textrm{л}}=0,21=21%$
$varphi (CO_2)= dfrac{V(CO_2)} {Vtextrm{(смеси)} } =dfrac{0.03textrm{л}}{100textrm{л}}=0,0003=0,03%$
$varphi textrm{(др.газов)}= dfrac{Vtextrm{(др.газов)}} {Vtextrm{(смеси)} } =dfrac{0.97textrm{л}}{100textrm{л}}=0,0097=0,97%$
Нетрудно заметить, что сумма объемных долей всех газов в смеси всегда равна 1, или 100%:
$varphi (N_2) + varphi (O_2) + varphi (CO_2) + varphi textrm{(др.газов)} = 78% + 21% + 0,03% + 0,97% = 100%$
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
Мольная доля
Мольная доля растворенного вещества показывает, какую часть от суммарного количества всех веществ, входящих в состав раствора, составляет количество растворенного вещества В.
Находят мольную долю растворенного вещества c как отношение числа моль растворенного вещества А к общему числу моль всех веществ в растворе:
$eta(A)=dfrac{n(A)}{n(A) + n(B)}(cdot 100%)$
Молярная концентрация
$C_text{в-ва}$ показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
$C_text{в-ва}= dfrac{n_text{в-ва}}{V} = dfrac{m_text{в-ва}}{M_text{в-ва}cdot V}$
где $M_text{в-ва}$ – молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается “M”. Например, 2 M NaOH – двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Кроме перечисленных способов выражения концентрации вещества следует также отметить моляльность и нормальность раствора. В аналитической химии часто используют титр.
Все перечисленные способы выражения концентрации обобщены в таблице:
| Название | Обозначение | Формула | размерность |
| массовая доля | $omega_text{в-ва}$ | $omega_text{в-ва}=dfrac{m_text{в-ва}}{m_text{р-ра}}(cdot 100%)$ | % или доли(безразмерная величина) |
| объемная доля | $varphi_text{в-ва}$ | $varphi textrm{(газа)} = dfrac{Vtextrm{(газа)} }{Vtextrm{(смеси)} } (cdot 100%)$ | % или доли(безразмерная величина) |
| мольная доля | $eta(A)$ | $eta(A)=dfrac{n(A)}{n(A) + n(B)}(cdot 100%)$ | % или доли(безразмерная величина) |
| молярная концентрация (молярность) | $C_text{в-ва}$ | $C_text{в-ва}= dfrac{n(B)}{V} = dfrac{m(B)}{M(B) cdot V}$ | моль/л |
| нормальная концентрация (нормальность) | $C_{textrm{н}}$ | $C_{textrm{н}} = dfrac{n_{textrm(экв.)}}{V}= C cdot z$ | моль экв. / л |
| моляльная концентрация (моляльность) | $m$ | $m=dfrac{ntextrm{(в-ва)}}{mtextrm{(р-ра)}}$ | моль / кг |
| титр | $T$ | $T=dfrac{mtextrm{(в-ва)}}{Vtextrm{(р-ра)}}$ | кг/ л |
НОРМАЛЬНАЯ КОНЦЕНТРАЦИЯ (нормальность раствора)
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
$C_{textrm{н}} = dfrac{n_{textrm(экв.)}}{V}= C cdot z$
где z -число эквивалентности, C – молярная концентрация
Определение
Грамм – эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ – это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
z(основания) = М(основания) / число замещаемых в реакции гидроксильных групп
z(кислоты) = М(кислоты) / число замещаемых в реакции атомов водорода
z(соли) = М(соли) / произведение числа катионов на его заряд
Величины нормальности обозначают буквой “Н”. Например, децинормальный раствор серной кислоты обозначают “0,1 Н раствор $H_2SO_4$”. Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор $H_2SO_4$ будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата $NaHSO_4$, и двухнормальным в реакции с образованием $Na_2SO_4$.
МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ (моляльность раствора)
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Моляльная концентрация (моляльность) равна числу молей растворенного вещества в 1 килограмме (1000 г.) растворителя. Единица измерения – [моль/кг]:
$m=dfrac{ntextrm{(в-ва)}}{mtextrm{(р-ра)}}$
ТИТР
показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см$^3 $ раствора:
$T=dfrac{mtextrm{(в-ва)}}{Vtextrm{(р-ра)}}$
Источник
