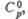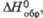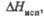Все оксиды хлора проявляют какие свойства
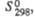
Кислородсодержащие
соединения хлора
HClO – хлорноватистая кислота. Ей
соответствует кислотный оксид Cl2O. Соли называются
гипохлоритами.
HClO2 – хлористая кислота.
Кислотный оксид Cl2O3 не получен. Соли – хлориты.
HClO3 – хлорноватая кислота. Кислотный
оксид Cl2O5 не получен. Соли – хлораты.
HClO4– хлорная кислота. Кислотный оксид –
Cl2O7. Соли – перхлораты.
1) HClO – желтоватая жидкость.
Существует только в растворах. Получается при взаимодействии хлора с водой (без
нагревания):
Cl2 + H2O
= HCl + HClO
Соли этой кислоты получаются при
действии на щелочь хлора:
2KOH + Cl2 =холод=
KClO + KCl + H2O
используется как отбеливатель в
текстильной промышленности.
2) HClO2, HClO3 –
не имеют ангидридов (кислотных оксидов). Соли этих кислот применяют в
пиротехнике и взрывных работах. Наибольшее значение имеет KClO3 – хлорат
калия (бертолетова соль), получаемая насыщением горячей щелочи хлором:
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
Хлораты – сильнейшие окислители.
При ударе или нагревании взрываются.
3) Известен оксид ClO2,
который можно получить по реакции:
2KClO3 +
H2C2O4 = K2CO3 +
CO2
+ H2O + 2ClO2
ClO2 –
зелено-желтый газ, при растворении в воде дает смесь кислот:
2ClO2 + H2O
= HClO2 + HClO3
4) Осторожным нагреванием хлораты
можно перевести в перхлораты, из которых можно получить хлорную кислоту:
KClO4 + H2SO4 =
HClO4 + KHSO4
Хлорная кислота HClO4 – подвижная
жидкость, очень взрывоопасная, самая сильная из всех известных кислот. Почти
все ее соли хорошо растворимы в воде.
5) В ряду: HClO → HClO2 →
HClO3 → HClO4 сила кислот растет, а
окислительная способность падает.
Кислородные
соединения галогенов
Галогены с кислородом
непосредственно не реагируют. Но кислородсодержащие кислоты галогенов (кроме
фтора) могут быть получены как продукты реакций диспропорционирования хлора,
брома и йода с водой и щелочами. При
взаимодействии хлора с водой часть растворенного хлора переходит в кислоту НСlO, называемую хлорноватистой
кислотой. В этой молекуле хлор в степени окисления + 1 связан с
кислородом:

Хлорноватистая кислота известна
только в водном растворе. Это неустойчивое вещество претерпевает различные
превращения. На свету кислород отщепляется от хлора:
HClO
-hν→ HCl + O
В момент образования кислород в
виде отдельных атомов очень активен, вследствие чего раствор проявляет сильное
окислительное действие. При отнятии воды, например, действием безводного
хлорида кальция, из сильно охлажденного раствора выделяется оксид хлора (I), Сl2O, в виде красно-бурой жидкости с
температурой кипения +3,8°С. Это тоже неустойчивое вещество, способное
взрываться. Растворяясь в воде, он снова образует хлорноватистую кислоту. При
нагревании раствора НСlO
происходит более глубокое диспропорционирование хлора с переходом в степень
окисления +5:
3HClO = 2HCl + HClO3
Образующееся кислородсодержащее
соединение называется хлорноватой кислотой. Это более
устойчивое соединение, сильная кислота, образующая растворы с массовой долей до
40%. Под действием серной кислоты хлорноватая кислота диспропорционирует,
образуя еще два новых соединения хлора:
3HCl+5O3
= HCl+7O4 + 2Cl+4O2 + H2O
Хлорная кислота НСlO4 содержит хлор в высшей
степени окисления +7. Второй продукт реакции оксид хлора (IV) содержит хлор в необычной для
него степени окисления +4. Хлор в этом состоянии имеет неспаренный электрон.
Это также неустойчивое, взрывчатое соединение хлора. В водном растворе СlO2 диспропорционирует на две
кислоты — хлорноватую и хлористую. В последней степень
окисления хлора +3:
2ClO2+H2O = HClO3 + HClO2
Таким образом, в рассмотренных
реакциях показано образование четырех кислородсодержащих кислот хлора,
образующих ряд с возрастающими нечетными степенями окисления и валентностями
хлора от +1 до +7 (табл.). В этом ряду наблюдается последовательное и резкое
возрастание силы кислот от очень слабой хлорноватистой до одной из самых
сильных хлорной. Усиление кислот в этом ряду связано с увеличением числа атомов
кислорода, соединенных с хлором двойными связями. Это способствует
делокализации заряда аниона, что затрудняет присоединение к нему иона водорода
с образованием молекулы кислоты.
Таблица.
Кислородсодержащие
кислоты хлора
Свойство | Формула | |||
HClO | НСlO2 | НСlO3 | НСlO4 | |
| ||||
Степень окисления хлора | + 1 | +3 | +5 | +7 |
Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
Название солей | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Все четыре кислоты являются
сильными окислителями, по силе превосходящими хлор. Вместе с тем, как очевидно
из протекания многочисленных реакций, окислительная активность резко падает в
ряду от HClO
к НСlO4. Например, хлорноватистая кислота
моментально выделяет йод из раствора йодида калия, а разбавленная хлорная
кислота с раствором КI
практически не реагирует. Хлорноватистая кислота и ее соли обесцвечивают
органические красители, в то время как хлорная кислота окисляющего действия на
них не оказывает. Таким образом, увеличение числа атомов кислорода, окружающих
атом хлора, способствует стабилизации как молекул кислот, так и анионов их
солей. Повышение устойчивости проявляется и в том, что из четырех кислот только
хлорная может быть получена в безводном состоянии.
Находящие практическое применение
соли хлорноватистой и хлорноватой кислот получаются взаимодействием хлора с
растворами щелочей. Гипохлорит калия КСlO служит отбеливающим средством. Он
получается пропусканием хлора в раствор гидроксида калия. Одновременно
образуется хлорид калия:
Cl2+2KOH
=холод=KClO+KCl+H2O
Этот раствор называется жавелевой
водой (Javel — местечко около Парижа, где впервые стали
изготовлять эту воду в 1792 году — раствор солей калия
хлорноватистой и соляной кислот KOCl + KCl). Кислота НСlO настолько слабая, что вытесняется
из соли под действием углекислого газа:
KClO
+ CO2 + H2O = KHCO3 + HClO
Эта кислота и обесцвечивает
красители.
Как активные окислители гипохлориты
нашли применение в медицине. Они проявляют дезинфицирующее, антисептическое,
противомикробное действие. Гипохлорит натрия NаСlO применяется в растворе с массовой
долей 0,06% для промывания ран, при операциях па грудной клетке, брюшной или
плевральной полостях. Выпускается раствор гипохлорита натрия и для инъекций.
Взаимодействием хлора с другой
щелочью — гидроксидом кальция в отсутствие воды получается практически важный
продукт хлорная известь. Это белый порошок, иногда серый или
желтоватый от присутствия примесей, пахнущий хлором. В составе хлорной извести
имеются СаС2, Са(СlO)2,
Са(ОН)2 и вода. Часто хлорную известь представляют, как
смешанную соль с двумя разными анионами: СаСl(СlO). Хлорная известь реагирует даже
со слабыми кислотами с выделением хлора:
СаСl(СlO) + CO2
=H2O= CaCO3 + Cl2↑
Выделяющийся хлор реагирует с
органическими веществами, в результате чего, в частности, гибнут
микроорганизмы. Поэтому хлорная известь широко применяется в санитарных целях.
Она применяется также для отбеливания бумаги и тканей и для лабораторного
получения хлора.
Пропусканием хлора в горячий
раствор гидроксида калия получают смесь двух солей — хлорида калия КCl и хлората калия КСlO3.
3Cl2 +
6KOH =t= KClO3 + 5KCl + 3H2O
При охлаждении раствора хлорат
калия начинает кристаллизоваться. При 20°С его растворимость составляет 7,4 г
на 100 г воды, в то время как растворимость хлорида калия равна 34 г. Хлорат
калия называют бертолетовой солью, так как он был впервые получен
К. Бертолле. Бертолетову соль предполагалось использовать в составе пороха
взамен селитры, но при испытаниях быстрая детонация такого пороха приводила к
разрыву пушечных стволов. Вместо этого бертолетова соль нашла широкое
применение в качестве окислителя в составах для фейерверков. Она является также
окисляющей составной частью спичечной головки. Кислород, отщепляющийся от хлора
в хлорате калия, в твердых смесях окисляет уголь, серу, фосфор, органические
вещества. Реакции сопровождаются яркими вспышками. Напишем реакцию сгорания
сахарозы:
C12H22O11+8KClO3
= 12CO2 +11H2O + 8KCl + 5647 кДж/моль
При нагревании хлорат калия и
другие соли кислородсодержащих кислот хлора разлагаются с выделением кислорода.
Разложение хлората калия ускоряется в присутствии оксида марганца(IV):
2KClO3
=MnO2= 3O2 + 2KCl
При нагревании бертолетовой соли
без катализатора происходит диспропорционирование хлора с образованием
перхлората калия:
4KClO3
=t=400C= 3KClO4 + KCl
При еще более сильном нагревании до
~520°С перхлорат калия тоже разлагается, выделяя кислород. Относительно высокая
термическая устойчивость перхлоратов и устойчивость их в растворах характерна и
для других солей с анионами, в которых центральный атом окружен четырьмя
атомами кислорода. Такие анионы имеют тетраэдрическое строение, а π-связи в них
полностью делокализованы.

Рисунок. Строение анионов кислородсодержащих кислот хлора
Кислородные соединения брома менее
устойчивы по сравнению с кислородными соединениями хлора. Оксид брома Вг2O разлагается уже при температуре
плавления -17°С. Свободный бром реагирует со щелочью при нагревании аналогично
хлору:
3Br2 +
6KOH =t= KBrO3 + 5KBr + 3H2O
Бромат натрия NaВrO3 применяется как окислитель в
аналитической химии. Например, по реакции с броматом калия определяют оксид
мышьяка (III):
3As2O3
+ 2KBrO3 + 9H2O = 6H3AsO4 +
2KBr
Бром трудно окислить до степени
окисления +7. До 1970 г. соли бромной кислоты НВrO4 не были получены, и в
учебниках иногда давались объяснения, почему они не существуют. Впервые
пербромат натрия был получен по реакции
NaBrO3
+ F2 + 2NaOH = NaBrO4 + 2NaF + H2O
Кислородные соединения йода более
устойчивы по сравнению с другими галогенами. В щелочном растворе йод диспропорционирует
аналогично брому. При пропускании хлора в водную суспензию йода образуется
йодноватая кислота:
I2
+ 5Cl2 + 6H2O = 2HIO3 + 10HCl
Из раствора йодноватая кислота
выделяется в виде устойчивого кристаллического вещества. При ее обезвоживании
получается оксид 12О5, устойчивый при обычных условиях. Он нашел применение для
анализа воздуха на присутствие оксида углерода(И). Анализ основан на реакции, сопровождающейся
выделением йода: 5СO
+ I2O5 = I2 + 5CO2
Известна также йодная кислота НIO4, которая может быть получена
действием хлорной кислоты на йод:
2HClO4 + I2 = 2HIO4 + Cl2
После испарения воды из раствора
йодной кислоты получаются бесцветные кристаллы НIO4*2Н2O. Из химических свойств этого
вещества следует, что все атомы кислорода связаны непосредственно с йодом, и
вещество представляет собой ортойодную кислоту Н5IO6.
Как известно, в группах (главных
подгруппах) усиливается металличность при переходе в группе сверху вниз. В
группе галогенов находятся элементы, наиболее далекие по свойствам от металлов.
И все же у тяжелого элемента йода проявляются признаки металличности. Черные
кристаллы йода имеют слабый металлический блеск, а электрическое сопротивление
значительно ниже, чем у такого типичного неметалла, как сера. Йод, подобно
металлам, может входить в состав вещества в качестве катиона. Неустойчивый
катион I+ может быть стабилизирован
образованием комплексного иона с органическими молекулами. При реакции йода с
нитратом серебра в присутствии пиридина С5Н5N образуется комплексный ион такого
типа:
I2+AgNO3+2С5Н5N
= [I(С5Н5N)2]NO3
+ AgI↓
Кислородные соединения фтора
интересны тем, что фтор является единственным элементом, по
электроотрицательности превосходящим кислород. Поэтому простейшее из этих
соединений ОF2 следует называть не оксидом
фтора, а фторидом кислорода. Это газообразное вещество получается при действии
фтора на 2%-ный раствор гидроксида натрия:
2F2 + 2NaOH = 2NaF + OF2↑+H2O
Своим угловым строением молекула
фторида кислорода напоминает молекулу воды, но их дипольные моменты µ направлены противоположно:

Фторид кислорода термодинамически
неустойчив, при t
> 200°С распадается
на кислород и фтор. Есть и более сложные по составу фториды кислорода.
Фтор, так же, как и кислород, не
проявляет высокой валентности, соответствующей номеру группы, так как не имеет
энергетически доступных свободных орбиталей для перехода в возбужденное
состояние.
Источник
- Химическая энциклопедия
ХЛОРА ОКСИДЫ
Все Х. о. имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит.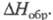 Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10−30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO+2MF−6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10−30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO+2MF−6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
СВОЙСТВА ОКСИДОВ ХЛОРА
таблица в процессе добавления
* Расчетная. ** 2,38 г/см3 при −160 °C.
Диоксид ClO2 — желтый газ, в жидком состоянии — ярко-красный, в твердом — красновато-желтый; длина связи С — О 0,1475 нм, угол OClO 117 °C; уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,7427 — 1275,1/T (226–312 К); растворимость в воде 26,1 г/л (25 °C, 20,68 кПа), раств. в CCl4, HClO4, CH3COOH. В индивидуальном состоянии взрывоопасен, при 30–50 °C распад идет с измеримой скоростью, выше 50 С после периода индукции взрывается. В щелочной среде ClO2 диспропорционирует на и
и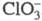 , в присутствии H2O2 образуется
, в присутствии H2O2 образуется и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 140 мг/кг (крысы, внутрижелудочно).
и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 140 мг/кг (крысы, внутрижелудочно).
Перхлорат хлора (цихлоротетраоксид) Cl2O4, или ClOClO3 — светло-желтая жидкость, в кристаллич. состоянии почти бесцветен (см. перхлораты).
Триоксид (дихлорогексаоксид) Cl2O6 — ярко-красная жидкость, в твердом состоянии — оранжевый, при охлаждении окраска ослабевает. В газе и жидкости молекулы имеют строение O2Cl — О — ClO3, в кристаллах –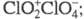 кристаллы моноклинной сингонии (пространств. группа
кристаллы моноклинной сингонии (пространств. группа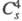 , z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
, z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид) Cl2O7 — бесцв. подвижная жидкость, чувствителен к удару и трению. Молекула имеет строение O3С1 — О — ClO3, длина связи С1 — О 0,1709 нм, в группах ClO3 — 0,1405 нм, угол ClOС1 118,6°, OClO 115,2°, μ 2,40∙10−30 Кл∙м; кристаллы моноклинные (пространств. группа C2/с); уравнение температурной зависимости давления пара lgp( мм рт. ст.) = 7,796-1770/Т. Неограниченно раств. в CCl4, хорошо раств. в HClO4, POCl3и т. п. С водой не смешивается, на границе раздела фаз реагирует с образованием HClO4, реакция сильно экзотермична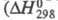 реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
Известен ряд хлоркислородных свободных радикалов, полученных в разл. низкотемпературных матрицах и исследованных преим. методом ЭПР,- ClO3, ClOO, ClClO, а также малостабильный сесквиоксид Cl2O3, распадающийся при −50 — 0 °C и имеющий, вероятно, структуру хлората хлора ClOClO2. Термически устойчивый радикал ClO (длина связи С1 — О 0,1569 нм, 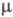 4,133 Кл∙м,
4,133 Кл∙м, 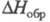 101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
Лит.: Никитин И. В., Химия кислородных соединений галогенов, М., 1986.
В. Я. Росоловский
Источник:
Химическая энциклопедия
на Gufo.me
Значения в других словарях
- ХЛОРА ОКСИДЫ —
ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто-коричневый газ) — диоксид ClO2 (зеленовато-желтый газ) — триоксид Cl2O6 (темно-коричневая жидкость) — хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 — отбеливатель целлюлозы, тканей, бумаги.
Большой энциклопедический словарь

Источник
ХЛОРА ОКСИДЫ. Все хлора оксиды имеют резкий
запах, термически и фотохимически нестабильны, склонны к взрывному распаду,
имеют положит.
Монооксид [оксид С1(I), дихлороксид, гемиоксид] С12О – желто-оранжевый
газ со слабым зеленоватым оттенком, в жидком состоянии – красно-коричневый;
длина связи С1 — О 0,1700 нм, угол ОСlO 111°,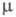 2,60
2,60
x 10-30 Кл x м (табл.); ур-ние температурной зависимости давления
пара lgp (мм рт. ст.) = 7,87 – 1373/Т (173-288 К); раств. в воде
с образованием НСЮ, р-римость (г в 100 г Н2О при 0 °С): 33,6
(2,66 кПа), 52,4 (6,65 кПа). При 60-100 °С термич. распад С12О
завершается за 12-24 ч, выше 110 °С через неск. мин происходит взрыв, освещение
ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды,
напр., с Т1С14, ТаС15 и AsCl3 дает соотв.
Т1ОС12, ТаОС13 и AsO2Cl. С NO2
образует смесь NO2C1 и NO3C1, с N2O5
-чистый NO3C1. Фторированием С12О с помощью AgF2
можно получить C1OF3, а р-цией с AsF5 или SbF5
– соли хлорила ClO+2MF-6. Аналогично
реагируют с MF5 (где М – As и Sb) С1О2 и С12О6.
С насыщ. орг. соединениями С12О ведет себя как хлорирующий агент,
подобный хлору. Получают Сl2О пропусканием С12, разбавленного
N2, над HgO или р-цией С12 с влажным Na2CO3.
СВОЙСТВА ОКСИДОВ ХЛОРА
Показатель | Сl2О | СlO2 | Сl2O4 | Сl2O6 | Сl2O7 |
Т. пл, оС | -120,6 | -59 | -117 | 3 | -93,4 |
Т. кип., °С | 2,0 | 9,7 | 44,5 | 203* | 87 |
Плотн., г/см3 | — | 1,653 (5 °С) | 1,82 (0°С) | 2,023 (3,5 °С) | 1,805** (25 °С) |
| 47,81 | 42,00 | 86,03 | ||
| 81 | 93 | 180 | 310 | 240 |
| 26 | 26,3 | 30 | 40 | 34 |
| 267,84 | 256,77 | 327,23 | — | — |
*Расчетная. **2,38 г/см3 при
-160 °С.
Диоксид С1О2 – желтый газ, в
жидком состоянии -ярко-красный, в твердом – красновато-желтый; длина связи
С — О 0,1475 нм, угол ОСlO 117 °С; ур-ние температурной зависимости давления
пара lgp (мм рт. ст.) = 7,7427 — 1275,1/T (226-312 К); р-римость
в воде 26,1 г/л (25 °С, 20,68 кПа), раств. в ССl4, НС1О4,
СН3СООН. В индивидуальном состоянии взрывоопасен, при 30-50
°С распад идет с измеримой скоростью, выше 50 С после периода индукции
взрывается. В щелочной среде С1О2 диспропорционирует на
и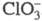 , в
, в
присут. Н2О2 образуется
и выделяется О2. Восстанавливается иодидами, арсенидами, PbO,
H2SO3, аминами до хлорит-иона. СNO2 и
N2O5 образует NO3C1, с NOC1 -NO2C1.
Фторируется посредством AgF2, BrF3 или разб. F2
до C1O2F. Получают СlO2 действием восстановителей
(SO2, NO2, метанол, орг. пероксиды) на подкисленный
р-р хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой
к-той, действием С12 на хлориты. В отличие от остальных хлора оксидов
С1О2 – продукт пром. произ-ва, его используют вместо С12
как экологически более безопасный продукт для отбеливания древесной пульпы,
целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания
сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.;
ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 140 мг/кг
(крысы, внутрижелудочно).
Перхлорат хлора (цихлоротетраоксид) С12О4,
или СlOС1О3 – светло-желтая жидкость, в кристаллич. состоянии
почти бесцветен (см. Перхлораты).
Триоксид (дихлорогексаоксид) С12О6
– ярко-красная жидкость, в твердом состоянии – оранжевый, при охлаждении
окраска ослабевает. В газе и жидкости молекулы имеют строение О2С1
— О — С1О3, в кристаллах –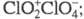 кристаллы моноклинной сингонии (пространств. группа
кристаллы моноклинной сингонии (пространств. группа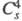 ,
,
z = 4); давление пара 39,9 Па (0 °С), 133 Па (19 °С). Медленно разлагается
уже при 0-10 °С на С1О2 и О2, выше 20 °С в продуктах
распада появляется С12; с водой реагирует со вспышкой, продукты
гидролиза – НС1О3 и НС1О4. С хлоридами, бромидами,
нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5
– NO2C1O4, с А1С13 -СlO2[А1(С1О4)4],
с FeCl3 – ClO2[Fe2(ClO4)7].
При нагр. в вакууме такие комплексы отщепляют С12О6
и превращаются в несольватированные перхлораты А1(С1О4)3,
Fe(ClO4)3. Получают С12О6 р-цией
озона с С1О2 или действием F2 на хлораты металлов.
Применяют для синтеза безводных перхлоратов в лаб. условиях.
Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид)
С12О7 – бесцв. подвижная жидкость, чувствителен к
удару и трению. Молекула имеет строение О3С1 — О — ClO3,
длина связи С1 — О 0,1709 нм, в группах С1О3 – 0,1405 нм, угол
СlOС1 118,6°, ОСlO 115,2°,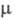
2,40 x 10-30Кл x м; кристаллы моноклинные (пространств. группа
С2/с); ур-ние температурной зависимости давления пара lgp(мм
рт. ст.) = 7,796-1770/Т. Неограниченно раств. в СCl4,
хорошо раств. в НС1О4, РОС13 и т. п. С водой не смешивается,
на границе раздела фаз реагирует с образованием НСlO4, р-ция
сильно экзотермична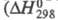
р-ции -211 кДж/моль); разогревание слоя С12О7 может
привести к взрыву. Распад С12О7 в газе на хлор и
кислород идет с измеримой скоростью при 100-120 °С, но при давлении С12О7
выше 13,3 кПа приобретает взрывной характер. Жидкий С12О7
устойчив до 60-70 °С, примесь низших хлора оксидов ускоряет его распад. Для жидкого
С12О7 характерны р-ции с образованием ковалентных
соед. с группой — С1О3. С NH3 в ССl4 образует
NH4HNC1O3 и NH4C1O4, с алкиламинами
-соотв. RHNC1O3 и R2NC1O3, с SbF5
– SbOF3 и FC1O3, с N2O5 в ССl4
NO2C1O4. Используя С12О7, можно
синтезировать орг. перхлораты из спиртов. Получают С12О7
действием Р2О5 или олеума на хлорную к-ту или электролизом
р-ра НС1О4 на Pt-электродах ниже 0 °С (С12О7
накапливается в анодном пространстве). Чистый С12О7
можно получить также при нагр. в вакууме нек-рых перхлоратов, напр. Nb(ClO4)5,
МоО2(СlO4)2.
Известен ряд хлоркислородных свободных
радикалов, полученных в разл. низкотемпературных матрицах и исследованных
преим. методом ЭПР,- СlО3, СlОО, СlСlО, а также малостабильный
сесквиоксид Сl2О3, распадающийся при -50 – 0 °С и
имеющий, вероятно, структуру хлората хлора СlOСlO2. Термически
устойчивый радикал СlO (длина связи С1 — О 0,1569 нм,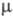
4,133 Кл x м,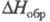
101,6 кДж/ моль) -промежут. продукт окисления углеводородов хлорной к-той
и хлора оксидами, распада всех хлора оксидов и др. хлоркислородных соед., а также р-ции
озона с атомарным хлором в стратосфере.
Лит.: Никитин И. В., Химия кислородных
соединений галогенов, М., 1986.
В.Я.Росоловский.
Источник