Какие анионы обладают буферными свойствами

Анонимный вопрос
25 января 2018 · 3,1 K
Буферные вещества связываются с водородам в кислотах в организме человека, что способствует поддержанию оптимального кислотно-щелочного баланса организма. Это очень важно, потому что чрезмерная закисленность организма увеличивает утомляемость и уменьшает скорость обменных профессов в организме. Внутри клетки буферность обеспечивается главным образом анионами фосфорной кислоты H2PO4− и НРО42−.
Какие функции выполняет вакуоли в клетке?
Cinemaphile & multi-instrumentalist. Love boxing & cycling, cats & dogs, cars &…
Вакуоли регулируют рост: поглощают воду и удлинняют клетки.
Хранят важные питательные вещества, ферменты и т.д.
Помогают в проростании семян, т.к. являются питательным веществом.
Выделяют ядовитые вещества, тем самым защищая растения от животных.
Разрушают крупные молекулы.
Отвечают за тургорное давление, чтобы структуры оставались жёсткими и прямыми.
Также вакуоли участвуют в автолизе – процессе, при котором клетка разрушается ферментами.
Прочитать ещё 3 ответа
Как проходит гидролиз фосфата натрия?
Engineer – programmer ⚡⚡ Разбираюсь в компьютерах, технике, электронике, интернете и… · zen.yandex.ru/gruber
Гидролиз фосфата натрия (Na3PO4) представляет собой взаимодействие Na3PO4 с водой (H2O). Другими словами, гидролиз — это разложение вещества водой.
Протекает он в щелочной среде и гидролизуется по аниону.
Молекулярное уравнение гидролиза фосфата натрия:
Na3PO4 + H2O -> Na2HPO4 + NaOH
Прочитать ещё 1 ответ
Какие ионы определяют буферные свойства цитоплазмы?
- Буферность – способность клетки поддерживать слабощелочную среду(pH)
ее содержимого на постоянном уровне, даже если в клетке повышается содержание катионов(H+) водорода или анионов гидроко-группы(OH-), срабатывает буферная система и в целом показатель pH не изменяется.
- В клетке работает фосфатная буферная система, она включает анионы гидрофосфаты (HPO4)2- и дигидрофосфаты (H2PO4)-
- Вне клетки работает карбонатная буферная система, она включает анионы карбонаты (CO3)2-и гидрокарбонаты (HCO3)-
- Если шире посмотреть на этот вопрос, то в поддержании постоянства буферности крови, например участвуют белки крови, за счет амфотерности аминокислот и в частности белок – гемоглобин
Прочитать ещё 1 ответ
Объясните гуманитарию, что означает понятие “энтропия”?
Филолог, мечтающий стать астрофизиком
Я понимаю так (если понимаю неправильно, пусть знающие люди меня поправят), что, в общем смысле, энтропия – это степень упорядоченности какой-либо системы, мера беспорядка, хаоса. И чем выше беспорядок, тем, соответственно, выше энтропия. И наоборот. Понятие энтропии используется во многих науках, но чаще, как правило, связывается со вторым законом термодинамики, который гласит, что в изолированной системе энтропия не может уменьшаться. Если говорить совсем простыми словами, то система – это нечто организованное, то, что имеет свою структуру, а изолированной можно назвать систему, на которую не оказывается воздействие извне (хотя совсем уж независимую систему найти трудно, так как все предметы и объекты друг с другом взаимодействуют, но это детали). Так вот, оставленное на солнце яблоко со временем сгниет, человек постареет. Энтропия всегда растет. Вселенная стремится к беспорядку. И именно из-за действия энтропии, как предполагается, время не может идти назад, хотя в физике не существует точного закона, постулирующего, что время обязательно должно идти только вперед. Если время пойдет назад, то все явления и вещи начнут сами по себе магическим образом упорядочиваться: разлетевшиеся бумаги сложатся ровной стопочкой, разбитый стакан соберется в целый без единой трещины, люди начнут молодеть. Повернуть время вспять значит упорядочить систему, то есть нарушить второй закон термодинамики. Нет, разбитый стакан, конечно, можно склеить в целый, и дома можно сделать уборку, однако при этом придется затратить какую-то часть энергии, и никакого нарушения в итоге не выйдет. Склеивание стакана и уборка дома – это только видимость уменьшения энтропии, так как даже аккуратно разложенные по местам вещи имеют свойство со временем разлагаться, так что от вездесущей энтропии нам не уйти.
Такие дела.
Прочитать ещё 5 ответов
Источник
Огромную роль для нормального функционирования человеческого организма играет кислотно-основное равновесие. Циркулирующая в организме кровь представляет собой смесь живых клеток, которые находятся в жидкой среде обитания. Первой чертой охраны, что контролирует уровень pH в крови, выступает буферная система. Это физиологический механизм, который обеспечивает сохранение параметров кислотно-основного баланса, препятствуя перепадам pH. Что он собой представляет и какие имеет разновидности, узнаем ниже.
Описание
Буферная система – это уникальный механизм. В организме человека существует их несколько, и все они состоят из плазмы и клеток крови. Буферы представляют собою основания (белки и неорганические соединения), которые связывают или отдают Н+ и ОН-, уничтожая сдвиг pH в течение тридцати секунд. Способность буфера поддерживать кислотно-основный баланс зависит от количества элементов, из которых он слагается.
Виды буферов крови
Кровь, которая постоянно движется, представляет собой живые клетки, которые существуют в жидкой среде. pH в норме составляет 7,37-7,44. Связка же ионов происходит определенным буфером, классификация буферных систем приведена ниже. Сам же он состоит из плазмы и кровяных клеток и может быть фосфатным, белковым, бикарбонатным или гемоглобиновым. Все эти системы имеют достаточно простой механизм действия. Их деятельность нацелена на урегулирование уровня ионов в крови.
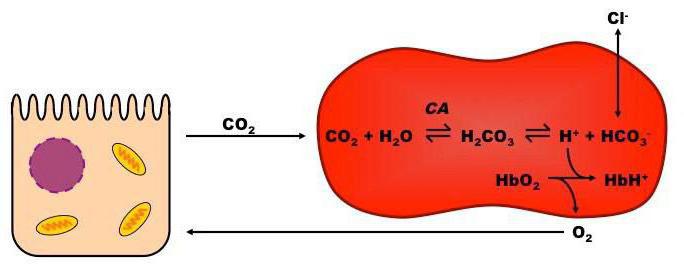
Особенности буфера гемоглобинового
Гемоглобиновая буферная система является самой мощной из всех, она представляет собой щелочь в капиллярах тканей и кислоту в таком внутреннем органе, как легкие. На ее долю приходится около семидесяти пяти процентов всей буферной емкости. Этот механизм участвует во множестве процессах, что происходят в крови человека, и имеет в своем составе глобин. При переходе гемоглобинового буфера в другую форму (оксигемоглобин), наблюдается изменение этой формы, изменяются и кислотные свойства действующего вещества.
Качество восстановленного гемоглобина меньшее, чем у угольной кислоты, но становится намного лучше, когда он окисляется. Когда приобретается кислотность pH, гемоглобин соединяет ионы водорода, получается так, что он уже восстановленный. Когда происходит очищение углекислого газа в легких, pH получается щелочным. В это время гемоглобин, который окислился, выступает донором протонов, при помощи чего происходит уравновешивание кислотно-основного баланса. Так, буфер, что состоит из оксигемоглобина и его калиевой соли, способствует выделению из организма углекислоты.
Эта буферная система выполняет немаловажную роль в дыхательном процессе, так как совершает транспортную функцию по переносу к тканям и внутренним органам кислорода и удалению из них углекислоты. Кислотно-основное равновесие внутри эритроцитов при этом придерживается на постоянном уровне, следовательно, в крови также.
Таким образом, когда кровь насыщается кислородом, гемоглобин превращается в сильную кислоту, а когда кислород он отдает, то превращается в достаточно слабую органическую кислоту. Системы оксигемоглобина и гемоглобина – взаимопревращающиеся, они существуют как одно целое.
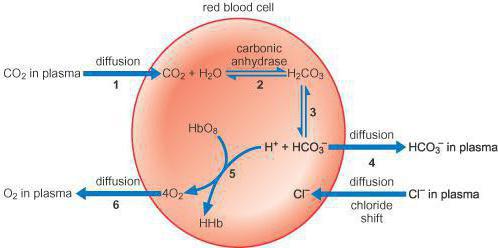
Особенности бикарбонатного буфера
Бикарбонатная буферная система выступает также мощной, но и самой управляемой в организме. На ее долю приходится около десяти процентов всей буферной емкости. Она имеет универсальные свойства, которые обеспечивают ее двухстороннюю эффективность. В состав этого буфера входит сопряженная кислотно-щелочная пара, что состоит из таких молекул, как угольная кислота (источник протона) и бикарбонат аниона (акцептор протона).
Так, бикарбонатная буферная система способствует протеканию систематического процесса, где в кровь попадает мощная кислота. Этот механизм связывает кислоту с бикарбонатом анионов, образуя кислоту угольную и ее соль. При попадании щелочи в кровь буфер связывается с угольной кислотой, образуя бикарбонатную соль. Так как гидрокарбоната натрия в крови человека больше, чем угольной кислоты, данная буферная емкость будет иметь высокую кислотность. Другими словами, гидрокарбонатная буферная система (бикарбонатная)очень хорошо проводит компенсацию веществ, которые повышают кислотность крови. К ним относится и молочная кислота, концентрация которой увеличивается при интенсивных физических нагрузках, а данный буфер очень быстро реагирует на изменения кислотно-основного баланса в крови.
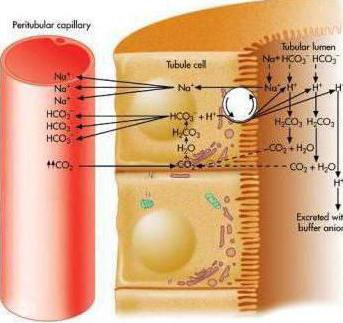
Особенности фосфатного буфера
Фосфатная буферная система человека занимает близко двух процентов всей буферной емкости, что связано с содержанием в крови фосфатов. Этот механизм поддерживает показатель pH в моче и жидкости, что находится внутри клеток. Буфер состоит из неорганических фосфатов: одноосновного (выполняет роль кислоты) и двухосновного (выполняет роль щелочи). При нормальном показателе pH соотношение кислоты и основания равняется 1:4. При увеличении количества ионов водорода фосфатная буферная система связывается с ними, образуя кислоту. Этот механизм больше кислотный, чем щелочной, поэтому он отлично нейтрализует поступающие в кровь человека кислые метаболиты, например, молочную кислоту.
Особенности белкового буфера
Белковый буфер играет не такую особую роль в стабилизации кислотно-щелочного баланса, по сравнению с другими системами. На его долю приходится около семи процентов всей буферной емкости. Белки состоят из молекул, которые объединяются в кислотно-щелочные соединения. В кислой среде они выступают щелочами, которые связывают кислоты, в щелочной среде все происходит наоборот.
Это приводит к тому, что образуется белковая буферная система, которая достаточно эффективна при значении pH от 7,2 до 7,4. Большая доля белков представлена альбуминами и глобулинами. Так как белковый заряд нулевой, то при нормальном показателе pH он находится в виде щелочи и соли. Эта буферная емкость зависит от количества белков, их структуры и свободных протонов. Данный буфер может нейтрализовать и кислые, и щелочные продукты. Но емкость она имеет больше кислотную, чем щелочную.
Особенности эритроцитов
В норме эритроциты имеют постоянный показатель pH – 7,25. Здесь оказывают действие гидрокарбонатный и фосфатный буферы. Но по мощности они отличаются от тех, что находятся в крови. В эритроцитах белковый буфер играет особую роль в обеспечении органов и тканей кислородом, а также удалению из них углекислоты. Кроме этого, он поддерживает постоянное значение внутри эритроцитов pH. Белковый буфер в эритроцитах тесно связан с гидрокарбонатной системой, так как соотношение кислоты и соли здесь меньшее, чем в крови.
Пример буферной системы
Растворы сильных кислот и щелочей, которые обладаю слабыми реакциями, имеют непостоянный показатель pH. Но смесь кислоты уксусной с ее солью сохраняет имеет стабильное значение. Даже если к ним добавить кислоту или щелочь, кислотно-основное равновесие не изменится. В качестве примера можно рассмотреть ацетатный буфер, который состоит из кислоты СН3СООН и ее соли СН3СОО. Если добавить сильную кислоту, то основание соли свяжет ионы Н+ и превратится в кислоту уксусную. Снижение уровня анионов соли уравновешивается увеличением молекул кислоты. В результате этого наблюдается незначительное изменение в соотношении кислоты и ее соли, поэтому pH изменяется совсем незаметно.
Механизм действия буферных систем
При поступлении в кровь кислых или щелочных продуктов буфер обеспечивает постоянное значение pH до тех пор, пока поступившие продукты не выведутся или не используются в процессах метаболизма. В крови человека представлены четыре буфера, каждый из которых состоит из двух частей: кислоты и ее соли, а также сильной щелочи.
Эффект буфера обуславливается тем, что он связывает и нейтрализует ионы, которые поступают соответствующим ему составом. Поскольку в природе организм больше всего сталкивается с недоокисленными продуктами обмена, свойства буфер имеет антикислотные больше, чем антищелочные.
Каждая буферная система имеет свой принцип работы. При снижении уровня pH ниже отметки 7,0 начинается их активная деятельность. Они начинают связывать излишки свободных ионов водорода, образуя комплексы, которые перемещают кислород. Он, в свою очередь, перемещается к системе пищеварения, легким, коже, почкам и так далее. Такая транспортировка кислых и щелочных продуктов способствует их разгрузке и выведению.
В организме человека только четыре буферные системы играют важные роли в сохранении кислотно-основного равновесия, но существуют и другие буферы, например, ацетатная буферная система, которая имеет слабую кислоту (донор) и ее соль (акцептор). Способность этих механизмов противостоять изменениям pH при попадании кислоты или соли в кровь является ограниченной. Они поддерживают кислотно-щелочное равновесие только в том случае, когда сильная кислота или щелочь поступают в определенном количестве. Если оно будет превышено, pH резко изменится, буферная система прекратит свое действие.
Эффективность буферов
Буферы крови и эритроцитов имеют различную эффективность. У последних она выше, так как здесь присутствует гемоглобиновый буфер. Уменьшение количества ионов происходит по направлению от клетки до межклеточной среды, а затем до крови. Это говорит о том, что самая большая буферная емкость у крови, а меньшую имеет внутриклеточная среда.
При метаболизме в клетках появляются кислоты, которые проходят в межклеточную жидкость. Это происходит тем легче, чем их больше появляется в клетках, поскольку переизбыток ионов водорода увеличивает проницаемость мембраны клетки. Нам уже известна классификация буферных систем. В эритроцитах они имеют более эффективные свойства, так как здесь еще играют роль коллагеновые волокна, которые реагируют набуханием на накопление кислоты, они ее поглощают и освобождают от ионов водорода эритроциты. Такая его способность обуславливается свойством абсорбции.
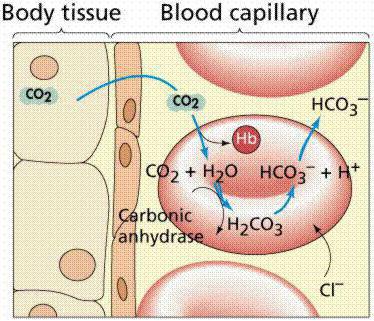
Взаимодействие буферов в организме
Все механизмы, которые находятся в организме, взаимосвязаны между собой. Буферы крови состоят из нескольких систем, вклад которых в поддержание кислотно-щелочного баланса различный. При попадании крови в легкие она получает кислород путем его связывания в эритроцитах гемоглобином, образуя оксигемоглобин (кислоту), что поддерживает уровень pH. При содействии карбоангидразы происходит параллельное очищение крови легких от углекислоты, которая в эритроцитах представлена в виде слабой двухосновной угольной кислотой и карбаминогемоглобином, а в крови – углекислотой и водой.
При уменьшении в эритроцитах количества слабой двухосновной угольной кислоты происходит проникновение ее из крови в эритроцит, и очищение крови от углекислоты. Таким образом, из клеток в кровь постоянно проходит слабая двухосновная угольная кислота, а из крови в эритроциты для соблюдения нейтральности поступают неактивные анионы хлорида. В результате этого в красных клетках крови среда более кислотная, чем в плазме. Все системы буферов обосновываются отношением донор-акцептор протона (4:20), что связано с особенностями метаболизма организма человека, который образует большее число кислотных продуктов, чем щелочных. Очень важным здесь является показатель кислотных буферных емкостей.

Обменные процессы в тканях
Кислотно-основной баланс поддерживается буферами и метаболическими превращениями в тканях организма. Этому помогают биохимические и физико-химические процессы. Они способствуют потере кислотно-щелочных свойств продуктов обмена веществ, их связыванию, образованию новых соединений, которые быстро выводятся из организма. Например, большое количество молочной кислоты выводится в гликоген, органические кислоты нейтрализуются солями натрия. Сильные кислоты и щелочи растворяются в липидах, а органические кислоты подвергаются окислению, образуя угольную кислоту.
Таким образом, буферная система – это первый помощник при нормализации кислотно-щелочного баланса в организме человека. Стабильность pH нужна для нормальной работы биологических молекул и структур, органов и тканей. При нормальных условиях буферные процессы поддерживают равновесие между появлением и удалением ионов водорода и углекислого газа, что способствует обеспечению в крови постоянного уровня pH.
Если происходит сбой в работе буферных систем, то у человека появляются такие патологии, как алкалоз или ацидоз. Все буферные системы взаимосвязаны и направлены на поддержание стабильного кислотно-основного равновесия. В организме человека постоянно образуется большое число кислых продуктов, которое эквивалентно тридцати литрам сильной кислоты.
Постоянство реакций внутри организма обеспечивают мощные буферы: фосфатный, белковый, гемоглобиновый и бикарбонатный. Существуют и другие буферные системы, но эти являются основными и самыми нужными для живого организма. Без их помощи у человека начнут развиваться различные патологии, которые могут привести к коме или летальному исходу.
Источник
1. Значения рН буферных растворов при добавлении небольших количеств кислот и оснований:
1) сохраняются постоянными, т. к. добавляемые катионы водорода и анионы гидроксила связываются соответственно акцепторами и донорами протонов буферной системы;
2) сохраняются примерно постоянными до тех пор, пока концентрации компонентов буферных систем будут превышать концентрации добавляемых ионов;
3) изменяются, т. к. изменяются концентрации кислот и оснований в системе.
2.Значения рН буферных растворов при разбавлении:
1) сохраняются постоянными, т. к. соотношение концентраций компонентов буферных систем не изменяется;
2) сохраняются примерно постоянными до определённых значений концентраций;
3) изменяются, т. к. концентрация компонентов системы уменьшается.
3. Какие из перечисленных сопряженных кислотно-основных пар обладают буферными свойствами? а) НСОО-/НСООН;
б) CH3СОО-/СН3СООН; в) Cl-/НС1; г) НСО3-/СО2, д) HPO42-/H2PO4-.
1) все;
2) а, б, г, д;
3) б, г, д;
4) б, г.
4. Из перечисленных сопряженных кислотно-основных пар выберите системы, обладающие буферными свойствами: a) H3PO4/H2PO4-
б) H2PO4-/HPO42-; в) HPO42-/PO43- г) HNO3/NO3-; д) НСООН/НСОО-.
1) все;
2) б, д;
3) а, б, в, д;
4) б, в, д.
5. Какие из кислотно-основных пар обладают буферными свойствами? а) Hb-/ННb; б) НbО2-/ННbО2; в) НСО3-/СО2; г) NH4+/NH4OH;
д) NO3-/HNO3?
1) все;
2) а, б, в, г;
3) а, б, в;
4) д.
6. Какие из кислотно-основных пар обладают буферными свойствами? а) С1-/НС1; б) NO3-/HNO3; в) HSO4-/H2SO4; г) СН3СОО-/СН3СООН;
д) NH4+/NH4OH?
1) все;
2) а, б, в;
3) г, д;
4) в, г, д.
7.Какие из сопряженных кислотно-основных пар обладают буферными свойствами?
а) НСОО-/НСООН; б) НРО42-/Н2РО4-; в) Н2РО4-/Н3РО4; г) НСО3-/СО2?
1) все;
2) а, б;
3) б, в, г;
4) а, г.
8. Какие из буферных систем содержат в своем составе только соли: а) СО32-/НСО3-;
б) НСО3-/СО2; в) HPO42-/ Н2РО4-; г) Н2РО4-/Н3РО4; д) НСОО-/НСООН; е) РО43-/НРО42-.
1) а, в, г;
2) а, в, е;
3) а, б, в, г, е;
4) а, б, в, г.
9. К буферным растворам относятся смеси; a) NaH2PO4 + Na2HPO4; б) Н3РО4 + NaH2PO4;
в) Na2CO3 + NaHCO3; г) Na2HPO4 + Na3PO4.
1) все;
2) а, б;
3) в, г;
4) а, б, в.
10. При добавлении НСl к буферной системе НРО42-/Н2РО4-:
1) активная концентрация (НРО42-)увеличивается, (Н2РО4-) – уменьшается;
2) активная концентрация (НРО42-) уменьшается, (Н2РО4-) – увеличивается;
3) активности компонентов не изменяются.
11.При добавлении NaOH к буферной системе НРО42-/Н2РО4-:
1) активная концентрация (НРО42-) увеличивается, (Н2РО4-) – уменьшается;
2) активная концентрация (Н2РО4-) увеличивается, (НРО42-) – уменьшается;
3) активные концентрации (НРО4-) и (Н2РО4-) не изменяются.
12. При добавлении NaOH к буферной системе NH4+/ NH3·H2O:
1) активная концентрация (NH4+) уменьшается, (NH3·H2O) увеличивается;
2) активная концентрация (NH4+) увеличивается, (NH3·H2O) уменьшается;
3) активные концентрации (NH4+) и (NH3·H2O) не изменяются.
13. При добавлении НСl к буферной системе NH4+/ NH3·H2O:
1) активная концентрация (NH4+) уменьшается, (NH3·H2O) – увеличивается;
2) активная концентрация (NH4+) увеличивается, (NH3·H2O) – уменьшается;
3) активные концентрации (NH4+) и (NH3·H2O) не изменяются.
14.При добавлении NaOH к буферной системе СН3СОО-/СН3СООН:
1) активная концентрация (СН3СООН) уменьшается, (СН3СОО-) – увеличивается;
2) активная концентрация (СН3СООН) увеличивается, (СН3СОО-) – уменьшается;
3) активные концентрации (СН3СООН) и (СН3СОО-) не изменяются.
15. При добавлении НСl к буферной системе СН3СОО-/СН3СООН:
1) активная концентрация (СН3СООН) уменьшается, (СН3СОО-) увеличивается;
2) активная концентрация (СН3СООН) увеличивается, (СН3СОО-) уменьшается;
3) активные концентрации (СН3СООН) и (СН3СОО-) не изменяются.
16. Максимальную буферную ёмкость системы имеют при:
1) рН = pKa;
2) рН > рKa;
3) pH< pKa;
4) эти параметры не взаимосвязаны друг с другом.
17. Максимальной буферной ёмкостью при физиологическом значении рН обладает кислотно-основная сопряженная пара:
1) Н3РО4/Н2РО4- (рКа (Н3РО4) = 2,1;
2) Н2РО4-/НРО42- (рКа (Н2РО4-) = 6,8;
3) НРО42-/РО43-(рКа (НРО42-) = 12,3.
18. При одинаковых концентрациях компонентов буферная ёмкость:
1) максимальна, т. к. рН = pKa;
2) максимальна, т. к. рН > pKa;
3) минимальна, т. к. рН = pKa;
4) буферная ёмкость не зависит от соотношения концентраций компонентов.
19. Буферная ёмкость при разбавлении растворов:
1) уменьшается, вследствие уменьшения концентрации всех компонентов системы;
2) увеличивается, т. к. возрастает степень диссоциации электролитов;
3) не изменяется, т. к. соотношение концентраций компонентов остается постоянным;
4) практически не изменяется, т. к. количество компонентов системы остается неизменным.
20. Буферные системы поддерживают в организме равновесия:
1) кислотно-основные;
2) окислительно-восстановительные;
3) гетерогенные;
4) лигандообменные.
21. Ацидоз – это:
1) уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
2) увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
3) увеличение основной буферной ёмкости физиологи ческой системы по сравнению с нормой.
22. Алкалоз – это:
1) уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
2) увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой;
3) уменьшение основной буферной ёмкости физиологической системы по сравнению с нормой.
23. Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары:
1) Н3РО4 – кислота, Н2РО4- – сопряженное основание;
2) Н2РО4- – кислота, НРО42- – сопряженное основание;
3) НРО42- – кислота, РО43- – сопряженное основание;
4) Н3РО4 – кислота, РО43– сопряженное основание.
24.При рН > рI белковый буфер будет состоять из сопряженной кислотно-основной пары:
1) биполярной молекулы белка (NH3+—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
2) биполярной молекулы белка (NH3+—Prot—COO-) и аниона белка (NH2—Prot—COO-);
3) аниона белка (NH2—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
4) белка (NH2- Prot – СООН) и аниона белка (NH2—Prot—COO-).
25. При рН < pI белковый буфер будет состоять из сопряженной кислотно-основной пары:
1) биполярной молекулы белка (NH3+—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
2) биполярной молекулы белка (NH3+—Prot—COO-) и аниона белка (NH2—Prot—COO-);
3) аниона белка (NH2—Prot—COO-) и катиона белка (NH3+—Prot—COOH);
4) белка (NH2—Prot—СООН) и катиона белка (NH3+—Prot—COOH).
26. При рН > рI глицин образует сопряженную кислотно-основную пару:
1) NH3+–СН2 – COO- / NH2–СН2–СОО-;
2) NH3+–СН2 –COO- / NH3+–СН2–СООН;
3) NH2–СН2–СООН / NH2–CH2–COO-;
4) NH2–CH2–COO- / NH3+–СН2– СООН.
27. При рН < рI глицин образует сопряженную кислотно-основную пару:
1) NH3+–СН2–COO- / NH2–СН2–СОО-;
2) NH3+–СН2–COO- / NH3+–СН2–СООН;
3) NH2–СН2–СООН / NH2–CH2–COO-;
4) NH2–CH2–COO- / NH3+–СН2– СООН.
28. Изоэлектрические точки большинства белков плазмы крови лежат в слабокислой среде,
(рI = 4,9-6,3), поэтому в крови в основном работает:
1) анионный белковый буфер;
2) катионный белковый буфер;
3) форма компонентов буфера не зависит от значения рН.
29. Буферная ёмкость свободных аминокислот плазмы крови максимальна при:
1) рI = рН;
2) рI < рН;
3) рI > рН;
4) буферная ёмкость не зависит от значения рН.
30.Буферная ёмкость белковой буферной системы крови больше:
1) по кислоте, т. к. в крови работает анионный белковый буфер;
2) по основанию, т. к. в крови работает катионный белковый буфер;
3) по кислоте, т. к. в крови работает катионный белковый буфер;
4) по основанию, т. к. в крови работает анионный белковый буфер.
31. Физиологическое значение рН поддерживается при соотношении компонентов бикарбонатной буферной системы, равном:
1) НСО3-/СО2 = 1:18;
2) НСО3-/СО2 = 4:1;
3) НСО3-/СО2 = 18:1;
4) НСО3-/СО2 = 1:4.
32. Физиологическое значение рН поддерживается при соотношении компонентов фосфатной буферной системы, равном:
1) НРО42-/Н2РО4- = 4:1;
2) НРО42-/Н2РО4- = 18:1;
3) Н2РО4-/НРО42- = 4:1;
4) НРО42-/Н2РО4- = 1:18.
33. При физиологическом значении рН соотношение концентраций компонентов в гидрокарбонатной буферной системе крови [НСО]/[СО2]. = 18:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию:
1) больше;
2) меньше;
3) их значения равны.
34. При физиологическом значении рН соотношение концентраций компонентов в фосфатной буферной системе крови [НРО]/[Н2РО] = 4:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию:
1) больше;
2) меньше;
3) их значения равны.
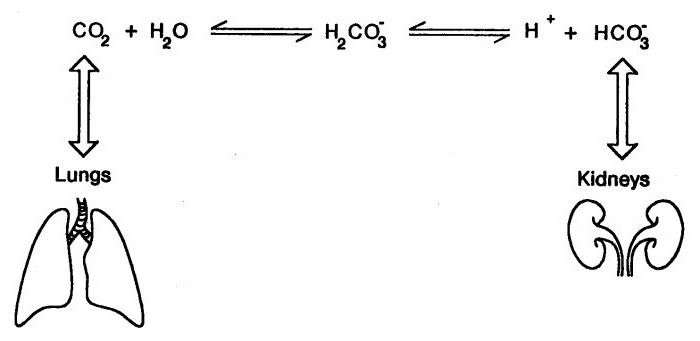
35. В организме имеет место следующее равновесие:
Н+ + НСО3- H2CO3 H2O + CO2 (плазма) CO2 (лёгкие).
При гиповентиляции легких:
1) щелочной резерв крови уменьшается, рН мочи увеличивается;
2) щелочной резерв крови уменьшается, рН мочи уменьшается;
3) щелочной резерв крови увеличивается, рН мочи увеличивается;
4) щелочной резерв крови увеличивается, рН мочи уменьшается.
36. В организме имеет место следующее равновесие:
Н+ + НСО3- H2CO3 H2O + CO2 (плазма) CO2 (лёгкие).
При гипервентиляции легких:
1) щелочной резерв крови уменьшается, рН мочи увеличивается;
2) щелочной резерв крови уменьшается, рН мочи уменьшается;
3) щелочной резерв крови увеличивается, рН мочи увеличивается;
4) щелочной резерв крови увеличивается, рН мочи уменьшается.
37. При гипотермии температуру в организме понижают до 24 °С. В этом режиме проводятся операции при патологии кровообращения. Значение рН = 7,36 будет в этом случае:
1) нормой;
2) ацидозом;
3) алкалозом.
38. При интенсивной физической нагрузке развивается метаболический ацидоз. Какой режим дыхания можно рекомендовать спринтеру перед началом бега для предварительной компенсации метаболического ацидоза?
1) гиповентиляцию лёгких;
2) режим дыхания не имеет значения;
3) гипервентиляцию легких.
39. Метод волевой ликвидации глубокого дыхания (МВЛГД), рекомендованный Бутейко, приводит к увеличению содержания СО2 в лёгких. При этом развивается:
1) респираторный ацидоз;
2) рН не изменяется;
3) респираторный алкалоз;
4) метаболический алкалоз.
40. У больных сахарным диабетом за счёт накопления в организме β-гидроксимасляной кислоты развивается:
1) метаболический алкалоз;
2) респираторный алкалоз;
3) метаболический ацидоз;
4) респираторный ацидоз.
41. При вдыхании чистого кислорода за счёт уменьшения парциального давления СО2 в лёгких развивается:
1) респираторный ацидоз;
2) респираторный алкалоз;
3) рН не изменяется;
4) метаболический ацидоз.
42. При заболеваниях, связанных с нарушением дыхательной функции лёгких (бронхите, воспалении легких и т. п.), приводящим к увеличению содержания СО2 в лёгких, наблюдается:
1) дыхательный ацидоз;
2) рН не изменяется;
3) дыхательный алкалоз;
4) метаболический алкалоз.
43. Увеличение щелочных продуктов метаболизма концентрацию СО2 в плазме крови:
1) увеличивает
2) уменьшает;
3) не изменяет.
44. Увеличение кислотных продуктов метаболизма концентрацию СО2 в плазме крови:
1) увеличивает;
2) уменьшает;
3) не изменяет.
45. Фосфатная буферная система действует:
1) в плазме крови;
2) в плазме крови и во внутренней среде эритроцитов;
3) во внутренней среде эритроцитов.
46. Гемоглобиновая буферная система действует:
1) в плазме крови;
2) в плазме крови и во внутренней среде эритроцитов;
3) во внутренней среде эритроцитов.
47. Наиболее быстродействующей в организме является буферная система:
1) фосфатная;
2) гидрокарбонатная;
3) белковая;
4) гемоглобиновая.
48. Максимальный относительный вклад в поддержание протолитического гомеостаза в плазме крови вносит буферная система:
1) гидрокарбонатная;
2) белковая;
3) гидрофосфатная;
4) гемоглобиновая.
49.Максимальный относительный вклад в поддержание протолитического гомеостаза во внутренней среде эритроцитов вносит буферная система:
1) гидрокарбонатная;
2) белковая;
3) гидрофосфатная;
4) гемоглобиновая.
50. При увеличении концентрации протонов во внутриклеточной жидкости происходит их нейтрализация гидрофосфат-ионами согласно уравнению реакции:
Н+ + HPO42- Н2РО4-.
При этом рН мочи:
1) уменьшается;
2) увеличивается;
3) не изменяется.
Дата добавления: 2016-11-20; просмотров: 4976 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Источник
