С какой степень окисления элементы проявляют только окислительные свойства

Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
5KCl+5O3+6P0 = 5KCl-1+3P2+5O5
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
- P0-5e- → P+5, фосфор (P0) является восстановителем, окисляясь до P+5 (степень окисления фосфора повышается на 5 единиц от 0 до +5).
- Cl+5+6e- → Cl-1, хлор (Cl+5) является окислителем, восстанавливаясь до Cl-1 (степень окисления хлора понижается на 6 единиц – от +5 до -1).
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
- В периодах с увеличением порядкового номера элемента (слева-направо) нарастают окислительные свойства и убывают восстановительные – натрий самый сильный восстановитель в третьем периоде, а хлор – самый сильный окислитель.
- В главных подгруппах, в пределах одной главной подгруппы с повышением порядкового номера (по направлению сверху-вниз) нарастают восстановительные свойства элементов и убывают окислительные – в VIIа группе фтор является сильным окислителем, а астат в некоторых соединениях проявляет восстановительные свойства.
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).

С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
- Элементарные катионы металлов (Na+, Cu2+, Ca2+) являются окислителями и не проявляют восстановительных свойств, окислительные свойства снижаются по мере роста активности металла.
- Ионы металлов с промежуточными степенями окисления могут проявлять, как восстановительные, так и окислительные свойства (Fe2+ – восстановитель; Fe3+ – окислитель).
- Элементарные анионы (Cl-, Br-, I-) являются восстановителями.
- Сложные ионы являются окислителями, если содержат атомы элементов с высокой степенью окисления (Cr2O72-, ClO3-,NO3-), при этом окислительные свойства обусловлены всем анионом, но не конкретным атомом, имеющим высокую степень окисления.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в максимальной степени окисления – такое вещество может быть только окислителем, например перманганат калия, в котором марганец имеет максимальную степень окисления, т.е., может только принимать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в низшей степени окисления – такое вещество может быть только восстановителем, например, сульфат марганца (II), в котором марганец имеет низшую степень окисления, т.е., может только отдавать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в промежуточной степени окисления, – такое вещество может быть как окислителем, так и восстановителем – все зависит от других реагирующих веществ и условий протекания реакции.
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
2SO2+O2 = 2SO3
2CO+SO2 = S+2SO2
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
Сернистая кислота в реакции с сероводородом играет роль окислителя, поскольку в молекуле H2S сера имеет степень окисления -2:
H2S+4O3+2H2S-2 = 3S0+3H2O
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
2H2S+4O3+O20 = 2H2SO4
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
- I2+5H2O2 → 2HIO3+4H2O – при pH=1 пероксид водорода является окислителем;
- 2HIO3+5H2O2 → I2+6H2O+5O2 – при pH=2 пероксид водорода является восстановителем.
Оксид марганца (IV) является окислителем только в кислотной среде:
MnO2+4H++2e- → Mn2++2H2O
Перманганат калия KMnO4 является окислителем в любой среде:
- кислая среда: MnO4-+8H++5e- → Mn2++4H2O
- щелочная среда: MnO4-+1e- → MnO42-
- нейтральная среда: MnO4-+2H2O+3e- → MnO2+4OH-
См. далее:
- Типичные восстановители
- Типичные окислители
Окислители и восстановители любят “свою” среду – в кислотной среде сила окислителей увеличивается, а в щелочной – увеличивается сила восстановителей.
См. далее Элементы-восстановители
Источник
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
Определение
Электроотрицательность (ЭО) $chi$ (хи) – величина, характеризующая способность атома элемента притягивать к себе электроны при образовании химической связи с другими атомами.
Современное понятие об электроотрицательности атомов введено американским учёным Лайнусом Полингом в 1932 году. Теоретическое определение электроотрицательности было разработано позднее. Американский физик Роберт Малликен предложил рассчитывать электроотрицательность как полусумму потенциала ионизации и сродства к электрону:
$chi_{textrm{М}} = dfrac {I + A_e}{2},$
где $I$ – потенциал ионизации, $A_e$ – энергия сродства к электрону.
Помимо шкалы Малликена, описанной выше, существует более 20-ти различных других шкал электроотрицательности (в основу расчёта значений которых положены разные свойства веществ), среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда-Рохова (основана на электростатической силе, действующей на внешний электрон) и др.
В настоящее время существует много способов, позволяющих количественно оценить величину электроотрицательности атома. Значения электроотрицательностей элементов, рассчитанные разными способами, как правило, не совпадают даже при введении поправочных коэффициентов. Однако общие тенденции в изменении $chi$ по Периодической системе сохраняются. Проиллюстрировать это можно, сравнив две наиболее широко использующиеся шкалы – по Полингу и по Олреду-Рохову (жирным шрифтом выделены значения ЭО по шкале Полинга, курсивом – по шкале Олреда-Рохова; $s$-элементы выделены розовым цветом, $p$-элементы – жёлтым, $d$-элементы – зелёным, $f$-элементы – голубым):



Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других.
Электроотрицательность связана с окислительно-восстановительной активностью элемента. Соответственно, чем больше электроотрицательность элемента, тем сильнее его окислительные свойства.
Чем более приближена электронная оболочка данного атома к электронной оболочке инертного газа, тем выше его электроотрицательность. Иными словами, в периодах по мере заполнения внешнего энергетического уровня электронами (то есть слева направо) электроотрицательность возрастает, так как возрастает номер группы и количество электронов на внешнем энергетическом уровне.
Чем дальше оказываются валентные электроны от ядра, тем слабее они удерживаются и тем ниже способность атома притягивать к себе дополнительные электроны. Таким образом, в группах электроотрицательность возрастает с уменьшением атомного радиуса, то есть снизу вверх. Элементом с наибольшей электроотрицательностью является фтор, а с наименьшей – франций. Типичные неметаллы, таким образом, имеют высокие значения электроотрицательности, а типичные металлы – низкие.

ВАЛЕНТНОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Валентность характеризует способность атомов данного химического элемента к образованию химических связей.
Валентность определяет число химических связей, которыми атом связан с другими атомами в молекуле.
Ранее валентность определяли как число атомов одновалентного элемента, с которым соединяется один атом данного элемента. Так, водород считается одновалентным элементом. В молекуле $HBr$ атом брома соединяется с одним атомом водорода, а атом серы в молекуле $H_2S$ – с двумя атома водорода. Следовательно, бром в $HBr$ одновалентен, а сера в $H_2S$ двухвалентна. Значения валентности для различных элементов могут изменяться от одного до восьми. Так, в хлорной кислоте $HClO_4$ элемент водород – одновалентный, кислород – двухвалентный, хлор – семивалентный. В молекуле оксида ксенона $XeO_4$ валентность ксенона достигает значения восемь. Все это наглядно демонстрируют следующие структурные формулы, в которых показан порядок связи атомов в молекуле друг с другом в соответствии с их валентностями (причем каждой единице валентности отвечает один валентный штрих):

Определение
В настоящее время под валентностью понимают число электронных пар, которыми данный атом связан с другими атомами.
Валентность (или ковалентность) определяется числом ковалентных связей, образуемых данным атомом в соединении. При этом учитываются как ковалентные связи, образованные по обменному механизму, так и ковалентные связи, образованные по донорно-акцепторному механизму.
Валентность не имеет знака!
Поскольку существует два механизма образования ковалентной связи (механизм спаривания электронов и донорно-акцепторный механизм), то валентные возможности атомов зависят от:
числа неспаренных электронов в данном атоме;
от наличия вакантных атомных орбиталей на внешнем уровне;
от числа неподеленных электронных пар.
Валентность элементов первого периода не может превышать I, валентность элементов второго периода не может превышать IV. Начиная с третьего периода валентность элементов может увеличиваться до VIII (например, $XeO_4$) в соответствии с номером группы, в которой находится элемент.
Рассмотрим, например, валентные возможности атомов ряда элементов.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ ВОДОРОДА
Атом водорода имеет единственный валентный электрон, что отражает электронная формула $1s^1$ или графическая формула:

За счет этого неспаренного электрона атом водорода может образовать только одну ковалентную связь с каким-либо другим атомом по механизму спаривания (или обобществления) электронов. Другие валентные возможности у атома водорода отсутствуют. Поэтому водород проявляет единственную валентность, равную I.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ ФОСФОРА
Элемент фосфор находится в третьем периоде, в главной подгруппе пятой группы. Электронная конфигурация его валентных электронов $3s^23p^3$ или

Являясь аналогом азота, фосфор также может проявлять валентности I, II, III и IV. Но так как для элементов третьего периода доступны вакантные $3d$-орбитали, атом фосфора может перейти в возбужденное состояние, переведя один из $s$-электронов на $d$-подуровень:

Таким образом, атом фосфора может образовать пять ковалентных связей по обменному механизму. Максимальную валентность V фосфор проявляет, например, в таких молекулах как $PF_5$, $H_3PO_4$, $POCl_3$ и др.:

СТЕПЕНЬ ОКИСЛЕНИЯ
Определение
Степень окисления – это условный заряд атома в соединении в предположении, что все связи в этом соединении ионные (т.е. все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Другими словами, степень окисления – это число, которое показывает, сколько электронов отдал (заряд «+») или принял (заряд «–») атом при образовании химической связи с другим атомом.
В отличие от валентности, степень окисления имеет знак – она может быть отрицательной, нулевой или положительной.
Для подсчета степеней окисления атомов в соединении имеется ряд простых правил:
Степень окисления элемента в составе простого вещества принимается равной нулю. Если вещество находится в атомарном состоянии, то степень окисления его атомов также равна нулю.
Ряд элементов проявляют в соединениях постоянную степень окисления. Среди них фтор (−1), щелочные металлы (+1), щелочно-земельные металлы, бериллий, магний и цинк (+2), алюминий (+3).
Кислород, как правило, проявляет степень окисления −2 за исключением пероксидов $H_2O_2$ (−1), супероксидов $MO_2$ ($-frac{1}{2}$), озонидов $M^IO_3, M^{II}(O_3)_2$ ($-frac{1}{3}$) и фторида кислорода $OF_2$ (+2).
Водород в соединении с металлами (в гидридах) проявляет степень окисления −1, а в соединениях с неметаллами, как правило, +1 (кроме $SiH_4, B_2H_6$).
Алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю, а в сложном ионе – заряду этого иона.
Высшая положительная степень окисления равна, как правило, номеру группы элемента в периодической системе.
Так, сера (элемент VIA группы), проявляет высшую степень окисления +6, азот (элемент V группы) – высшую степень окисления +5, марганец – переходный элемент VIIБ группы – высшую степень окисления +7. Это правило не распространяется на элементы побочной подгруппы первой группы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIII группы. Также не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор.
Низшая отрицательная степень окисления для элементов-неметаллов определяется вычитанием номера группы из числа 8.
Так, сера (элемент VIA группы), проявляет низшую степень окисления −2, азот (элемент V группы) – низшую степень окисления −3.
На основании приведенных выше правил можно найти степень окисления элемента в любом веществе.
Пример 1
Найти степень окисления серы в кислотах $H_2SO_3$, $H_2S_2O_5$, $H_2S_3O_{10}$.
Очевидно, что степень окисления водорода равна +1, кислорода −2. Обозначим степень окисления серы как q. Тогда можно записать:
$2cdot (+1) + q + 3 cdot (−2) = 0 hspace {3 mm} q = +4$
$2cdot (+1) + 2q + 5 cdot (−2) = 0 hspace {3 mm} q = +4$
$2 cdot (+1) + 3q + 10 cdot (−2) = 0 hspace {3 mm} q = +6$
Таким образом, в первых двух кислотах степень окисления серы одинакова и равна +4, в последней кислоте +6.
Пример 2
Найти степень окисления хлора в соединениях:
а) $KClO_3$;
б) $Ca(ClO_4)_2$;
в) $Al(ClO_2)_3$.
Сначала найдем заряд сложных ионов, в состав которых входит хлор, помня при этом, что молекула в целом электронейтральна.
$overset{+1}{H}overbrace{ClO_3} hspace{2cm} overset{+2}{Ca}overbrace{(ClO_4)}_2 hspace{2cm} overset{+3}{Al}overbrace{(ClO_2)}_3 $
$+1 + x = 0 hspace{1.5cm} +2 + 2x = 0 hspace{1.5cm} +3 + 3x = 0$
$x = – 1 hspace{2.3 cm} x = – 1 hspace{2.6 cm} x = – 1$
$overset{x}(Cloverset{-2}{O_3})^{-1}$
Источник
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.

Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Рис. 1. Ряд электроотрицательности.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название | Символ | Степень окисления |
Водород | H | +1, -1 |
Гелий | He | |
Литий | Li | +1 |
Бериллий | Be | +2 |
Бор | B | -1, 0, +1, +2, +3 |
Углерод | C | -4, -3, -2, -1, 0, +2, +4 |
Азот | N | -3, -2, -1, 0, +1, +2, +3, +4, +5 |
Кислород | O | -2, -1, 0, +1, +2 |
Фтор | F | -1 |
Неон | Ne | |
Натрий | Na | +1 |
Магний | Mg | +2 |
Алюминий | Al | +3 |
Кремний | Si | -4, 0, +2, +4 |
Фосфор | P | 3, 0, +3, +5 |
Сера | S | 2, 0, +4, +6 |
Хлор | Cl | 1, 0, +1, +3, +5, +7, редко +2 и +4 |
Аргон | Ar | |
Калий | K | +1 |
Кальций | Ca | +2 |
Скандий | Sc | +3 |
Титан | Ti | +2, +3, +4 |
Ванадий | V | +2, +3, +4, +5 |
Хром | Cr | +2, +3, +6 |
Марганец | Mn | +2, +3, +4, +6, +7 |
Железо | Fe | +2, +3, редко +4 и +6 |
Кобальт | Co | +2, +3, редко +4 |
Никель | Ni | +2, редко +1, +3, +4 |
Медь | Cu | +1, +2, редко +3 |
Цинк | Zn | +2 |
Галлий | Ga | +3, редко +2 |
Германий | Ge | -4, +2, +4 |
Мышьяк | As | -3, +3, +5, редко +2 |
Селен | Se | -2, +4, +6, редко +2 |
Бром | Br | -1, +1, +5, редко +3, +4 |
Криптон | Kr | |
Рубидий | Rb | +1 |
Стронций | Sr | +2 |
Иттрий | Y | +3 |
Цирконий | Zr | +4, редко +2, +3 |
Ниобий | Nb | +3, +5, редко +2, +4 |
Молибден | Mo | +3, +6, редко +2, +3, +5 |
Технеций | Tc | +6 |
Рутений | Ru | +3, +4, +8, редко +2, +6, +7 |
Родий | Rh | +4, редко +2, +3, +6 |
Палладий | Pd | +2, +4, редко +6 |
Серебро | Ag | +1, редко +2, +3 |
Кадмий | Cd | +2, редко +1 |
Индий | In | +3, редко +1, +2 |
Олово | Sn | +2, +4 |
Сурьма | Sb | -3, +3, +5, редко +4 |
Теллур | Te | -2, +4, +6, редко |
Иод | I | -1, +1, +5, +7, редко +3, +4 |
Ксенон | Xe | |
Цезий | Cs | +1 |
Барий | Bа | +2 |
Лантан | La | +3 |
Церий | Ce | +3, +4 |
Празеодим | Pr | +3 |
Неодим | Nd | +3, +4 |
Прометий | Pm | +3 |
Самарий | Sm | +3, редко +2 |
Европий | Eu | +3, редко +2 |
Гадолиний | Gd | +3 |
Тербий | Tb | +3, +4 |
Диспрозий | Dy | +3 |
Гольмий | Ho | +3 |
Эрбий | Er | +3 |
Тулий | Tm | +3, редко +2 |
Иттербий | Ib | +3, редко +2 |
Лютеций | Lu | +3 |
Гафний | Hf | +4 |
Тантал | Ta | +5, редко +3, +4 |
Вольфрам | W | +6, редко +2, +3, +4, +5 |
Рений | Re | +2, +4, +6, +7, редко -1, +1, +3, +5 |
Осмий | Os | +3, +4, +6, +8, редко +2 |
Иридий | Ir | +3, +4, +6, редко +1, +2 |
Платина | Pt | +2, +4, +6, редко +1, +3 |
Золото | Au | +1, +3, редко +2 |
Ртуть | Hg | +1, +2 |
Талий | Tl | +1, +3, редко +2 |
Свинец | Pb | +2, +4 |
Висмут | Bi | +3, редко +3, +2, +4, +5 |
Полоний | Po | +2, +4, редко -2, +6 |
Астат | At | – |
Радон | Ra | |
Франций | Fr | – |
Радий | Ra | +2 |
Актиний | Ac | +3 |
Или использовать на уроках этот вариант таблицы.

Рис. 2. Таблица степеней окисления.
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
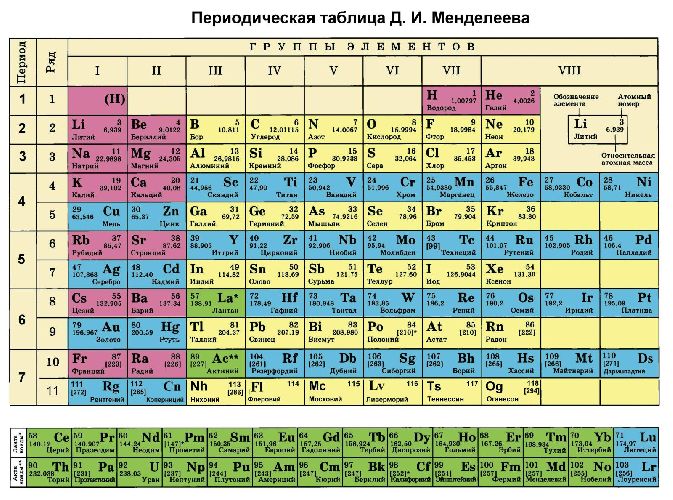
Рис. 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5

Паша Кривов
4/5

Александр Котков
5/5

Лидия Маслова
5/5
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 207.
Источник
